题目内容
【题目】下列有关叙述正确的是( )
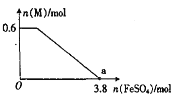
A.由反应:M(s)+N(g) ![]() R(g) △H1 ,M(g)+N(g)
R(g) △H1 ,M(g)+N(g) ![]() R(g) △H2,得出△H 2>△H 1
R(g) △H2,得出△H 2>△H 1
B.已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
C.电解精炼铜时,电源负极与纯铜相连,且电解质溶液浓度始终保持不变
D.用惰性电极电解 Na2SO4溶液,当阴极产生1mol气体时,可加18 g 水使溶液恢复
【答案】D
【解析】
A.M(s)→M(g)是吸热过程,则△H1>△H2,故A错误;
B.2SO2(g)+O2(g)![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,由于反应是可逆反应,SO2不可能完全被氧化,所以放出的热量<49.15kJ,故B错误;
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,由于反应是可逆反应,SO2不可能完全被氧化,所以放出的热量<49.15kJ,故B错误;
C.电解精炼铜时,粗Cu作阳极,则电源负极与纯铜相连,但电解精炼铜时,阳极上溶解的金属不仅有铜还有其它金属,阴极上只析出铜,所以溶解的铜小于析出的铜,导致溶液中铜离子浓度减小,故C错误;
D.用惰性电极电解Na2SO4溶液,由于溶液中阴离子的放电顺序为:OH->SO42-,放电为OH-,阳离子放电顺序为:H+>Na+,放电为H+,故实质为电解水:2H2O![]() 2H2↑+O2,当阴极产生1molH2气时,有2mol电子转移时,可加入18g水恢复,故D正确;
2H2↑+O2,当阴极产生1molH2气时,有2mol电子转移时,可加入18g水恢复,故D正确;
故答案为D。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
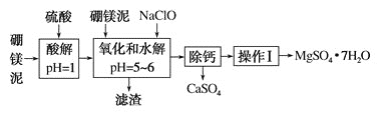
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸900 mL,配制时所用的玻璃仪器除了烧杯、玻璃棒、量筒外,还需________________。
(2)加入的NaClO可将Mn2+氧化为MnO2 ,反应中无气体产生,反应的离子方程式为:________________。还有一种离子也会被NaClO氧化,反应的离子方程式为_______________________。
(3)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法:___________________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
S(MgSO4)/g | 30.9 | 33.4 | 35.6 | 36.9 |
S(CaSO4)/g | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4的混合溶液中的CaSO4除去,根据上表数据,可确定操作步骤为蒸发结晶、_______________________(填操作名称)。