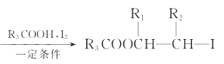题目内容
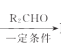
【题目】在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)![]() 2HI(g)已经达到平衡的标志是( )
2HI(g)已经达到平衡的标志是( )
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H2的生成速率之比是2∶1
C.单位时间内一个H-H键断裂的同时有两个H-I键断裂
D.单位时间里断裂2nmolHI的同时生成nmolI2
【答案】D
【解析】
A. HI的生成速率与HI的分解速率相等,说明正反应速率与逆反应速率相等,即达到平衡状态,A项正确;
B. HI的生成速率与H2的生成速率之比是2∶1,根据各物质的化学反应速率之比等于化学计量数之比可知,当转换成同一物质H2后能反映出正反应速率与逆反应速率相等,即可说明达到平衡状态,B项正确;
C. 单位时间内一个H-H键断裂的同时有两个H-I键断裂,说明正反应速率与逆反应速率相等,即达到平衡状态,C项正确;
D. 单位时间里断裂2n mol HI的同时生成n mol I2,只代表逆反应方向的速率,不能说明正反应速率是否等于逆反应速率,因此不能说明反应是否达到平衡状态,D项错误;
答案选D。

【题目】镓(31Ga)、锗(32Ge)都是重要的稀有金属,在化学催化剂、半导体材料、新能源等领域应用广泛,可从锗煤燃烧后的粉煤灰(含 Ga2O3、GeO2、SiO2、Al2O3)中提取, 部分流程如下:

已知:
物质 | GaCl3 | GeCl4 | AlCl3 |
沸点/℃ | 201 | 84 | 183(升华) |
(1)滤渣的主要成分为_____。
(2)①中发生的反应有 Al2O3+6H+=2Al3++3H2O、Ga2O3+6H+=2Ga3++3H2O 和_____。
(3)操作 a 的名称是_____,②中控制温度的范围是_____(填字母序号)。
a.20~84℃ b.84~183℃ c.84~201℃
(4)④中发生反应的化学方程式是__________________________________________。
(5)镓能与沸水剧烈反应生成氢气,锗在加热条件下与盐酸或稀硫酸不反应。从原子结构角度解释其原因:______________________
(6)用浓盐酸酸化的磷酸三丁酯(TBP)可以从残液中萃取 Ga3+,相关反应为:TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
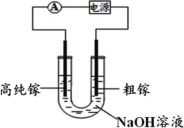
(7)电解法可以提纯粗镓,具体原理如图所示。镓在阳极溶解生成的 Ga3+与 NaOH 溶液反应生成 GaO![]() ,GaO
,GaO![]() 在阴极放电的电极反应式是_____________________。
在阴极放电的电极反应式是_____________________。