题目内容
【题目】下列说法中正确的是

A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于P区
C.HF晶体沸点高于HCl,是因为 HCl共价键键能小于HF
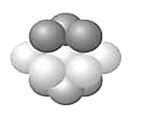
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
【答案】A
【解析】
A.PH4+、PO43-中都形成4个![]() 键,且孤电子对数分别为0,则应为正四面体结构,选项A正确;
键,且孤电子对数分别为0,则应为正四面体结构,选项A正确;
B.Ge位于第四周期第IVA族,则Ge是32号元素,原子核外电子排布式为[Ar]3d104s24p2,属于P区元素,选项B错误;
C.HF分子间能形成氢键,HCl分子间不能形成氢键,氢化物中含有氢键的熔沸点较高,HF的沸点高于HCl,与分子内的共价键无关,选项C错误;
D.团簇分子中含有4个E、4个F原子,分子式应为E4F4或F4E4,选项D错误;
答案选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~4min的平均反应速率:v(H2O2)>3.3×10-2mol·L-1·min-1
C.反应至6 min时,H2O2分解了50%
D.反应至6 min时,c(H2O2)=0.25 mol/L