题目内容
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是____,基态铁原子的核外电子排布式为_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________晶体(填晶体类型)。CO2在高温高压下所形成的晶体其晶胞如下图所示。则该晶体的类型属于_________晶体(填晶体类型)。
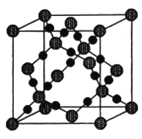
(3)铜晶体中铜原子的堆积方式如下图所示。其中铜原子的配位数为_______。
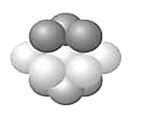
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________(填“CuCl2”或“CuCl”)的晶胞。
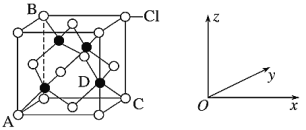
②原子坐标参数表示晶胞内部各原子的相对位置。上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为_______。
③图示晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为_____g·cm-3。(列出计算式即可)相对原子质量:Cu 64 Cl 35.5
【答案】第四周期第Ⅷ族 [Ar]3d64s2 或1s22s22p63s23p63d64s2 分子晶体 原子晶体 12 CuCl (![]() ,
,![]() ,
,![]() )
) 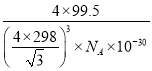 g/cm3
g/cm3
【解析】
(1)铁元素位于第四周期第Ⅷ族;
(2)根据晶体的性质进行判断;
(3)金属铜采用面心立方最密堆积;
(4)①根据均摊法计算;
②根据空间结构判断D原子的坐标参数;
③结合晶体计算公式进行计算。
(1)铁元素位于第四周期第Ⅷ族;为26号元素,基态铁原子的核外电子排布式为[Ar]3d64s2 或1s22s22p63s23p63d64s2;
(2)晶体熔沸点较低,所以属于分子晶体;
由CO2在高温高压下所形成的晶体的晶胞图可知,在晶胞中原子之间通过共价键结合,形成空间网状结构的晶体,属于原子晶体;
(3)金属铜采用面心立方最密堆积,其配位数=3×8×![]() =12;
=12;
(4)①晶胞中Cl-的个数为8![]() +6
+6![]() =4,Cu的个数为4,则化学式为CuCl,属于CuCl的晶胞;
=4,Cu的个数为4,则化学式为CuCl,属于CuCl的晶胞;
②D与周围4个原子形成正四面体结构,D与顶点C的连线处于晶胞体对角线上,且DC间距离为对角线的![]() 处,则D原子的坐标参数为(
处,则D原子的坐标参数为(![]() ,
,![]() ,
,![]() );
);
③已知一个晶胞中含有4个CuCl,设晶胞的边长为a,则CD间距离为![]() a,则a=
a,则a=![]() pm,则晶胞的体积为a3,晶胞的密度为
pm,则晶胞的体积为a3,晶胞的密度为![]() =
=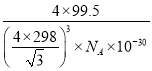 g/cm3。
g/cm3。

【题目】常温下,浓度均为0.1 molL-1的4种钠盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中不正确的是
A. 四种溶液中,Na2CO3溶液中水的电离程度最大
B. 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度
C. NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32-
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3