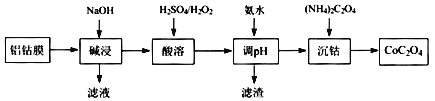
题目内容
【题目】A、B、C、D、E、F、G元素原子序数依次增大。已知B原子最外层有3个未成对电子,C原子最外层电子数与核外电子总数之比为3:4,E与C同主族,F-、D+、A+离子的半径逐渐减小,化合物AF常温下为气体,G的基态原子核外M能层填满电子,N能层只有1个电子。
据此回答下列问题:
(1)写出D元素基态原子的核外电子排布式____________;B、C、E三种元素的第一电离能由大到小的顺序是(用元素符号表示)_____________________
(2)A与C可形成1 8电子分子,其水溶液中滴人少量氯化铁溶液时有大量气泡逸出,写出该反应的化学方程式_______________________________________
(3)某化合物由上述七种元素中的三种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为______________;该化合物水溶液不呈中性的原因是(用离子方程式表示)________________________。
(4)0.3molG的低价氧化物能与____________molB的最高价氧化物对应水化物的溶液恰好完全反应(设还原产物只有BO)。
(5)卫星零射时可用B2A4为燃料,l mol气态B2A4在适量C2中燃烧,生成B2和气态A2C,放出534 kJ的热量,l mol液态A2C完全气化需吸收44 kJ热量。请写出气态B2A4在C2中燃烧生成B2和液态A2C时的热化学方程式________________________。
【答案】ls22s22p63sl N>O>S 2H2O2![]() 2H2O+O2↑ 离子键、(极性)共价键 ClO-+H2O
2H2O+O2↑ 离子键、(极性)共价键 ClO-+H2O![]() HClO+ OH- 1.4 N2H4(g)+O2(g) =N2(g)+ 2 H2O(1) ΔH= -622KJ/mol
HClO+ OH- 1.4 N2H4(g)+O2(g) =N2(g)+ 2 H2O(1) ΔH= -622KJ/mol
【解析】
根据题意可知A、B、C、D、E、F、G分别为H、N、O、Na、S、Cl、Cu;
(1)第一电离能同周期从左到右为增大趋势,从上到下依次减小,N为半充满状态,反常,故有N>O>S。
(2)AC形成18电子物质,可以采用9+9,确定为H2O2,在三氯化铁催化下发生分解,生成氧气和水;
(3)由消毒剂可以对该物质进行猜测为NaClO,然后进行相关的推断;
(4)3Cu2O+14HNO3=6Cu(NO3)2+2NO+4H2O,故0.3mol反应,消耗HNO31.4mol;
(5)N2H4(g)+O2(g) =N2(g)+ 2 H2O(g) ΔH= -534KJ/mol;
H2O(g)=H2O(l) ΔH= -44KJ/mol;根据盖斯定律可以计算得到反应热,写出热化学方程式。

【题目】常温下,浓度均为0.1 molL-1的4种钠盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中不正确的是
A. 四种溶液中,Na2CO3溶液中水的电离程度最大
B. 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度
C. NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32-
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3
【题目】已知:H2(g)+I2(g)![]() 2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
起始浓度 | c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)(mol·L-1) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率