题目内容
【题目】M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数;R和T在同一族;N的外围电子总数为6,均为未成对电子。根据以上信息,回答下列问题:
(1)T的元素符号为___________,在周期表中位于__________族,N的价电子排布式为___________。
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式:_________________________。
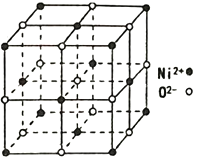
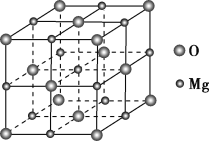
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为_____________。

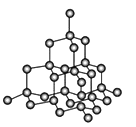
(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为__________,配位数为__________。N与甲基丙烯酸根的配合物为:
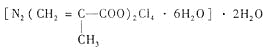 该化合物中存在的化学键类型有__________。甲基丙烯酸分子中C原子的杂化方式有_____________。
该化合物中存在的化学键类型有__________。甲基丙烯酸分子中C原子的杂化方式有_____________。
【答案】Co VIII 3d54s1 2Fe+3Cl2![]() 2FeCl3 1:2 +3 6 配位键、共价键 sp3、sp2
2FeCl3 1:2 +3 6 配位键、共价键 sp3、sp2
【解析】
M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数,则T的核外电子排布式为1s22s22p63s23p63d74s2,M能层中成对电子数与其它各能层上电子的总数均为12,故推出T为Co;R和T在相邻主族,则R为Fe;N的外围电子总数为6,均为未成对电子,则N的价层电子排布式为3d54s1,为Cr元素,再结合题设条件分析作答。
根据上述分析可知:
(1)T的元素符号为Co,在周期表中位于VIII族,N为Cr,其价电子排布式为3d54s1,故答案为Co;VIII;3d54s1;
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,可推出M为Cl元素,这两种常见化合物为FeCl2和FeCl3,其中铁可与氯气点燃生成氯化铁,该反应的化学方程式:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)结合图示根据均摊法可以看出,颗粒表面上每个氮原子为4个Fe原子共有,每个Fe原子为2个氮原子共有,则氮原子与铁原子的个数比为![]() =1:2;
=1:2;
(4)依据分析可知,该配合物为[Co(NH3) 3(H2O)Cl2]Cl,[Co(NH3) 3(H2O)Cl2]+为配合物的内界,Cl-为外界,内界中心离子为Co3+,配体为NH3、H2O和Cl-,因此中心离子化合价为+3;配位数为3+1+2=6;Cr与甲基丙烯酸根的配合物中,存在配位键与共价键;甲基丙烯酸分子中以共价单键结合的C原子采用sp3杂化,以共价双键结合的C原子采用sp2杂化方式,故答案为+3;6;配位键、共价键;sp3、sp2。

【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。

(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |