题目内容
【题目】(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为__________ g·cm-3(列出计算式)。

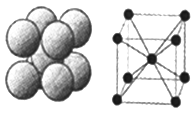
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为________g·cm-3;晶胞中Fe2+位于S![]() 所形成的正八面体的体心,该正八面体的边长为____nm。
所形成的正八面体的体心,该正八面体的边长为____nm。

(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
(4)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为____________nm。

【答案】![]()
![]() ×1021
×1021 ![]()
![]() 0.148 0.076
0.148 0.076
【解析】
(1)晶胞中Li+个数是8、O2-个数是4,晶胞体积=(0.4665×10-7 cm)3,晶胞密度=![]() ;
;
(2)晶胞边长为anm=a×10-7cm,晶胞体积=(a×10-7cm)3,该晶胞中Fe2+个数=4,S22-个数=4,其晶体密度=![]() ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长根据正方形对角线的长度计算;
;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长根据正方形对角线的长度计算;
(3)根据d=![]() 计算;
计算;
(4)MgO中O2-离子采用面心立方最密堆积方式,则晶胞面对角线上的O2-离子紧密相邻,2个O2-核间距(即2个O2-半径之和)等于晶胞棱长的![]() ;2 r(O2-)+2 r(Mn2+)=晶胞棱长。
;2 r(O2-)+2 r(Mn2+)=晶胞棱长。
(1)1个氧化锂晶胞含O的个数为8×![]() +6×
+6×![]() =4,含Li的个数为8,1 cm=107 nm,代入密度公式计算可得Li2O的密度为
=4,含Li的个数为8,1 cm=107 nm,代入密度公式计算可得Li2O的密度为![]() g·cm-3;故答案为:
g·cm-3;故答案为:![]() ;
;
(2)该晶胞中Fe2+位于棱上和体心,个数为12×![]() +1=4,S22-位于顶点和面心,个数为8×
+1=4,S22-位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,故晶体密度为=
=4,故晶体密度为=![]() =
=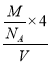 =
=![]() =
=![]() ×1021g/cm3;根据晶胞结构,S22-所形成的正八面体的边长为该晶胞中相邻面的面心之间的连线之长,即为晶胞边长的
×1021g/cm3;根据晶胞结构,S22-所形成的正八面体的边长为该晶胞中相邻面的面心之间的连线之长,即为晶胞边长的![]() ,故该正八面体的边长为
,故该正八面体的边长为![]() a nm;故答案为:
a nm;故答案为:![]() ×1021;
×1021;![]() ;
;
(3)由d=![]() =
=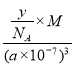 可知,y=
可知,y=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)因为O2-采用面心立方最密堆积方式,所以面对角线长度是O2-半径的4倍,则有[4r(O2-)]2=2a2,解得r(O2-)=![]() ×0.420 nm≈0.148 nm;MnO也属于NaCl型结构,根据晶胞的结构可得2r(Mn2+)+2r(O2-)=a′,代入数据解得r(Mn2+)=0.076 nm;故答案为:0.148,0.076。
×0.420 nm≈0.148 nm;MnO也属于NaCl型结构,根据晶胞的结构可得2r(Mn2+)+2r(O2-)=a′,代入数据解得r(Mn2+)=0.076 nm;故答案为:0.148,0.076。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。

①仪器m的名称为___________,装置F中试剂的作用是__________。
②装置连接顺序:A→_______________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和_____________。
(2)S2Cl2遇水强烈反应产生烟雾,该反应的化学方程式2S2Cl2+2H2O=SO2↑+3S↓+4HCl↑甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,该方案_________(填“可行”或“不可行”),原因是___________。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是____________(填标号)。
aH2O2溶液 bKMnO4溶液(硫酸酸化) c氯水
②该混合气体中气体X的体积分数为_____________(用含V、m的式子表示)。