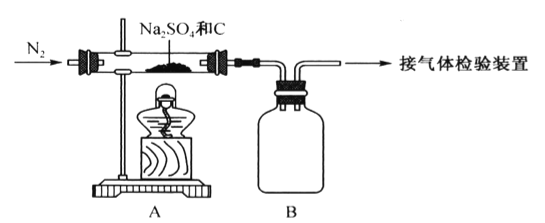
题目内容
【题目】碳的氧化物对环境的影响较大,CO是燃煤工业生产中的大气污染物,CO2则促进了地球的温室效应。给地球生命带来了极大的威胁。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为_____________________________。
(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
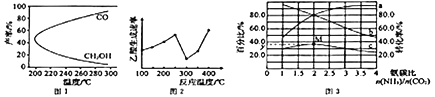
(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
【答案】 CO2(g)+ 3H2(g)=CH3OH(l)+H2O(l) △H=-131.0 kJ·mol-1 > 增大 向逆反应方向 250 增大反应体系的压强或增大CO2的浓度或使CH3COOH液化抽离等 b 20 36.4
【解析】(1)甲醇的燃烧热△H=-726.4kJmol-1,可得甲醇燃烧的热化学方程式:①CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=-726.4kJmol-1,氢气的燃烧热△H=-285.8kJmol-1,可得氢气燃烧的热化学方程式:②H2(g)+
O2(g)═CO2(g)+2H2O(l)△H=-726.4kJmol-1,氢气的燃烧热△H=-285.8kJmol-1,可得氢气燃烧的热化学方程式:②H2(g)+ ![]() O2(g)═H2O(l)△H=-285.8kJmol-1,根据盖斯定律,②×3-①得:CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-131.0kJ/mol,故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-131.0kJ/mol;
O2(g)═H2O(l)△H=-285.8kJmol-1,根据盖斯定律,②×3-①得:CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-131.0kJ/mol,故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-131.0kJ/mol;
(2)根据图1,升高温度CO2(g)+H2(g)![]() CO(g)+H2O(g) 中CO的产率增大,平衡正向移动,正反应为吸热反应,△H2>0; CH3OH的产率减小,平衡逆向移动,正反应为放热反应,△H1<0;增大反应体系的压强,CO2(g)+3H2(g)
CO(g)+H2O(g) 中CO的产率增大,平衡正向移动,正反应为吸热反应,△H2>0; CH3OH的产率减小,平衡逆向移动,正反应为放热反应,△H1<0;增大反应体系的压强,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)平衡正向移动,使得二氧化碳和氢气的物质的量减小,副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)平衡正向移动,使得二氧化碳和氢气的物质的量减小,副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) 中反应物的量减少,平衡逆向移动,故答案为:>;增大;向逆反应方向;
CO(g)+H2O(g) 中反应物的量减少,平衡逆向移动,故答案为:>;增大;向逆反应方向;
(3)根据图像,在250℃时乙酸的生成速率最高,说明该温度下催化剂的活性最强,因此使用催化剂的最佳温度是250℃;欲提高CH4的转化率,需要平衡正向移动,可以采取的措施有增大反应体系的压强或增大CO2的浓度或使CH3COOH液化抽离等,故答案为:250;增大反应体系的压强或增大CO2的浓度或使CH3COOH液化抽离等;
(4)增加氨碳比(![]() ),氨气的转化率降低,根据图像,曲线b表示NH3转化率;曲线c表示尿素在平衡体系中的体积分数变化曲线,M点对应的
),氨气的转化率降低,根据图像,曲线b表示NH3转化率;曲线c表示尿素在平衡体系中的体积分数变化曲线,M点对应的![]() =2,则加入的CO2为1mol,NH3为2mol,平衡时CO2和NH3的转化率均为80%,
=2,则加入的CO2为1mol,NH3为2mol,平衡时CO2和NH3的转化率均为80%,
CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)
CO(NH2)2(g)+H2O(g)
起始(mol) 1 2 0 0
反应(mol) 0.8 1.6 0.8 0.8
平衡(mol) 0.2 0.4 0.8 0.8
平衡浓度(mol/L)0.2 0.4 0.8 0.8
则M点的平衡常数K=![]() =20;尿素在平衡体系中的体积分数等于物质的量分数,则y=
=20;尿素在平衡体系中的体积分数等于物质的量分数,则y=![]() ×100%=36.4%,故答案为:b;20;36.4。
×100%=36.4%,故答案为:b;20;36.4。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】合成气(CO+H2) 广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气,
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5kJ的热量,请写出该反应的热化学方程式________________;
(2)在150℃时2L 的密闭容器中,将2molCH4和2mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=________。
②在该温度下,计算该反应的平衡常数K=________。
③下列选项中能表示该反应已达到平衡状态的是________。
A.V(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C(CH4)=C(CO)
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是_______________;
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2 的体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | v甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | v乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | v丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.v乙 >v>v甲 D.P乙>P甲=P丙
(4)合成气可以制取甲醚,绿色电源“二甲醚-氧气燃料电池”工作原理如下图所示
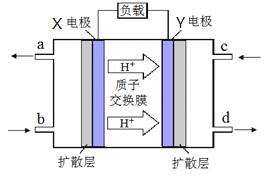
① 电极Y 上发生的反应式为__________ ;
②电池在放电过程中,电极X周围溶液的pH_______(填“增大、减小、不变”)。
【题目】有四种短周期元素,它们的结构、性质等信息如表所述:
元素 | 结构、性质等信息 |
X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质与冷水剧烈反应 |
Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒剂和杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置________;其相对分子质量最小的气态氢化物常用作______。
(2)工业上制取Y单质常用的方法是(用化学方程式表示)_________。
(3)Y离子半径比Z离子的半径________(填“大”或“小”)。
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于________(填“吸热”或“放热”)反应,写出反应的化学方程式为______________。
(5)举出实例说明M的非金属性比X强:_____________。