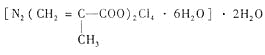题目内容
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题。
(1)氮、磷、砷的电负性的大小关系是 ,砷原子M层电子排布式为 。
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为 ,该化学键能够形成的原因是 。
(3)已知:
CH4 | SiH4 | NH3 | PH3 | |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,沸点高低的原因是 。
② NH3和PH3比较,分解温度高低的原因是 。
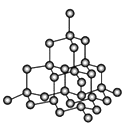
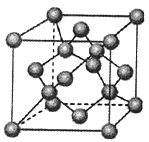
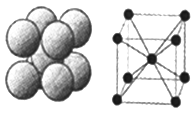
(4)金刚石是原子晶体,含有的最小环是六元环(如右边图),每个碳原子连接 个六元环,如左边图是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率 (不要求计算过程)。
【答案】(1)N>P>As(2分) 3s23p63d10(2分)
(2)配位键(1分) Fe3+提供空轨道,CN-提供孤电子行成配位键(2分)
(3)①CH4和SiH4比较,影响熔沸点的因素是分子间作用力,SiH4之间的分子间作用力大,熔沸点高 (2分) ② NH3和PH3比较,影响分解温度的因素是共价键的强弱,N原子的半径比P原子的半径小,共价键的键长短,供价键强,分解温度高(2分)
(4)12(2分) ;![]() (2分)
(2分)
【解析】
试题(1)同主族自上而下电负性逐渐减小,则氮、磷、砷的电负性的大小关系是N>P>As,砷原子原子序数是33,则根据核外电子排布规律可知M层电子排布式为3s23p63d10。
(2)由于Fe3+提供空轨道,CN-提供孤电子行成配位键,所以K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型
(3)①CH4和SiH4比较,二者形成的晶体类型均是分子晶体,影响熔沸点的因素是分子间作用力,SiH4之间的分子间作用力大,熔沸点高。
②NH3和PH3比较,影响分解温度的因素是共价键的强弱,N原子的半径比P原子的半径小,共价键的键长短,供价键强,因此分解温度高。
(4)在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接4个碳原子,连接的4个C原子中每个C原子形成3个六元环,所以金刚石晶体中每个C原子能形成12个六元环;根据金刚石晶胞结构图可知,金刚石晶胞中含有的碳原子数为8×1/8+6×1/2+4=8,所以共含有8个碳原子;晶胞内含有四个碳原子,则晶胞体对角线长度与四个碳原子直径相同,即![]() 。碳原子的体积为:
。碳原子的体积为:![]() ,晶胞体积为:a3,碳原子的空间利用率为:
,晶胞体积为:a3,碳原子的空间利用率为: =
= ![]() 。
。