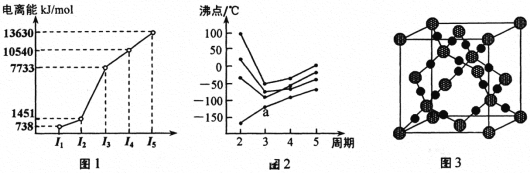
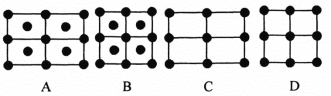
题目内容
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

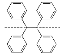
(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。

(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
【答案】分子晶体 O>N>C>H sp2杂化 be M能形成分子内氢键,使溶解度减小 3d9 3d轨道上没有未成对电子(3d轨道上电子为全空或全满)
【解析】
(1)X难溶于水、易溶于有机溶剂,则X为分子晶体;
(2)M中所含元素为C、H、O、N,由各元素在周期表中的位置知非金属性由强到弱的顺序为O>N>C>H,非金属性越强、元素的电负性越大,所以电负性由大到小的顺序为O>N>C>H;M中N原子形成2个σ键、N上还有1对孤电子对,则N原子以sp2杂化轨道与O原子形成σ键;
(3)对比反应物和生成物的结构,反应中断裂O—H键,形成配位键,答案选be;
(4)分析M的结构,其水溶性小,是因为M分子内存在氢键;
(5)基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,则基态Cu2+的外围电子排布式为3d9;根据题给过渡元素离子的外围电子排布式和过渡元素水合离子的颜色分析,Sc3+、Zn2+的3d轨道上没有未成对电子导致Sc3+、Zn2+的水合离子为无色。

 阅读快车系列答案
阅读快车系列答案【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
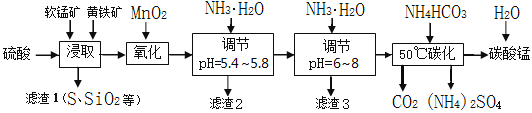
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
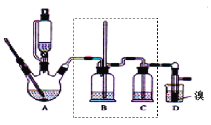
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入___,其目的是_____,装置A中生成副产物乙醚的化学反应方程式 ______。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放_____
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_____的方法除去。