题目内容
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。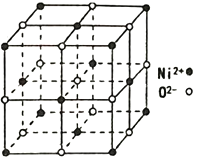
【答案】 3d84s2 23 6 O sp3 sp2 分子晶体 O>C>Ni 2:1 正八面体 ![]()
【解析】试题分析:本题考查物质结构与性质,涉及价层电子排布式的书写,电负性的比较,原子杂化方式的判断,σ键和π键的判断,配位化合物,晶体类型的判断,晶胞的分析和计算。
(1)Ni的原子序数为28,基态Ni原子核外有28个电子,根据构造原理,基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2,价层电子排布式为3d84s2。Fe原子核外有26个电子,Fe3+核外有23个电子,每个电子的运动状态都不相同,基态Fe3+有23种不同运动状态的电子。基态Cr原子核外有24个电子,基态Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,3d上5个电子和4s上的1个电子为未成对电子,基态Cr原子有6个未成对电子。
(2)配合物[Cr(H2O)6]3+中,中心离子为Cr3+,配体为H2O,Cr3+具有空轨道,H2O中O原子上有孤电子对,O原子提供孤电子对与Cr3+形成配位键,与Cr3+形成配位键的原子是O。CH3CHO中—CH3中碳原子形成4个共价单键,—CH3中碳原子为sp3杂化,—CHO中碳原子形成1个碳氧双键和2个单键,—CHO中碳原子为sp2杂化。
(3)由于Ni(CO)4常温下是无色液体,易溶于有机溶剂,Ni(CO)4是分子晶体。非金属性O![]() C
C![]() Ni,元素的非金属性越强,元素的电负性越大,组成Ni(CO)4三种元素电负性由大到小的顺序为O
Ni,元素的非金属性越强,元素的电负性越大,组成Ni(CO)4三种元素电负性由大到小的顺序为O![]() C
C![]() Ni。CO的结构式为C
Ni。CO的结构式为C![]() O,三键中有1个σ键和2个π键,CO分子中π键与σ键的个数比为2:1。
O,三键中有1个σ键和2个π键,CO分子中π键与σ键的个数比为2:1。
(4)根据NiO的立方晶体结构知,O2-周围等距离最近的Ni2+有6个,6个Ni2+构成正八面体,O2-填入Ni2+构成的正八面体空隙。用“均摊法”,晶胞中含Ni2+:8![]() +6
+6![]() =4,含O2-:12
=4,含O2-:12![]() +1=4;晶胞中原子的体积为4
+1=4;晶胞中原子的体积为4![]() π(r1
π(r1![]() 10-10cm)3+4
10-10cm)3+4![]() π(r2
π(r2![]() 10-10cm)3=4
10-10cm)3=4![]() π(r13+r23)
π(r13+r23)![]() 10-30cm3;1mol晶体的质量为75g,1mol晶体的体积为
10-30cm3;1mol晶体的质量为75g,1mol晶体的体积为![]() cm3,晶胞的体积为4
cm3,晶胞的体积为4![]() cm3;该晶胞中原子的体积占晶胞体积的百分率为4
cm3;该晶胞中原子的体积占晶胞体积的百分率为4![]() π(r13+r23)
π(r13+r23)![]() 10-30cm3
10-30cm3![]() (4
(4![]() cm3)
cm3)![]() 100%=
100%=![]()
![]() 100%。
100%。