题目内容
19.下列离子方程式的书写及评价均合理的是( )| A. | 将2mol Cl2通入到含1mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2正确;Cl2过量,Fe2+、Br-均被氧化 | |
| B. | 用Cu电极电解NaCl溶液阳极的电极反应式:2Cl--2e-═Cl2↑正确;Cl-优先于OH-放电 | |
| C. | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3-正确;H2SO3的酸性强于HClO | |
| D. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O正确;Mg(OH)2比MgCO3更难溶 |
分析 A.二价铁离子、溴离子都具有还原性,氯气足量时,二者均被氧化;
B.铜电极做阳极,为活性电极,阳极放电物质为铜;
C.二氧化硫具有还原性,能够被次氯酸根离子氧化成硫酸根离子;
D.Mg(HCO3)2溶液与足量的NaOH溶液反应生成氢氧化镁、碳酸钠和水.
解答 解:A.Cl2过量,Fe2+、Br-均被氧化,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2,离子方程式书写错误,故A错误;
B.用Cu电极电解NaCl溶液,阳极为活性电极,阳极的电极反应式:Cu-2e-=Cu2+,评价及离子方程式错误,故B错误;
C.HClO有强氧化性,能够氧化SO2,正确的离子方程式为:SO2+H2O+ClO-=Cl-+SO42-+2H+,评价及离子方程式均不合理,故C错误;
D.Mg(HCO3)2溶液与足量的NaOH溶液,反应生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O,离子方程式和评价都正确,故D正确;
故选:D.
点评 本题考查了离子方程式的书写及判断,题目难度中等,注意掌握离子方程式的书写原则,本题中既要判断离子方程式是否正确,还要判断题中评价是否合理.

练习册系列答案
相关题目
9.在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A. | 四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | 四种元素均可与氢元素形成18电子分子 | |
| D. | 四种元素中.Z的最高价氧化物对应水化物酸化最强 |
4.迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )
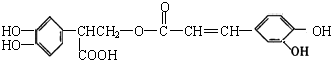
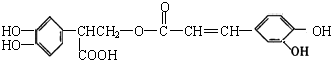
| A. | 迷迭香酸能使酸性高锰酸钾及溴的四氯化碳溶液褪色,属于芳香烃 | |
| B. | 迷迭香酸的分子式为C18H15O8,其在碱性条件下的水解反应叫皂化反应 | |
| C. | 迷迭香酸分子中含有5种官能团 | |
| D. | 1mol迷迭香酸跟H2反应,最多可消耗7molH2 |
11.生活中处处有化学.下列说法不正确的是( )
| A. | 令人讨厌的地沟油可以用于制肥皂 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |
8.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( )
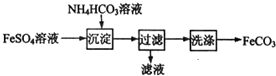

| A. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| B. | 沉淀过程中有CO2气体放出 | |
| C. | 过滤搡作的常用玻璃仪器有烧杯、漏斗和玻璃棒 | |
| D. | 产品FeCO3在空气中高温分解可得到纯净的FeO |
9.化学在生产和日常生活中有着重要的应用.下列说法错误的是( )
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| C. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
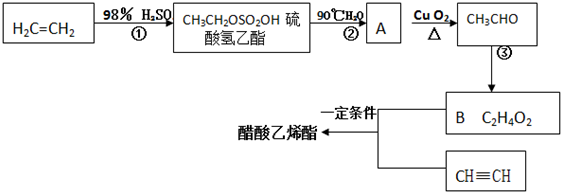
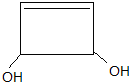 .
.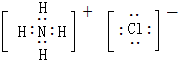 ,Y的最简单氢化物分子呈三角锥型;
,Y的最简单氢化物分子呈三角锥型;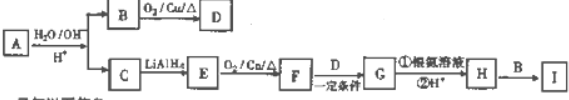
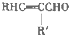 +H2O
+H2O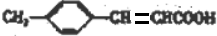 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$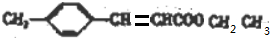 +H2O,反应类型为取代反应(酯化反应).
+H2O,反应类型为取代反应(酯化反应).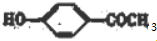 (写结构简式).
(写结构简式).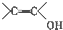 )结构.
)结构.