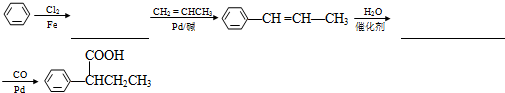题目内容
4.迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )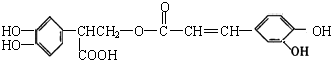
| A. | 迷迭香酸能使酸性高锰酸钾及溴的四氯化碳溶液褪色,属于芳香烃 | |
| B. | 迷迭香酸的分子式为C18H15O8,其在碱性条件下的水解反应叫皂化反应 | |
| C. | 迷迭香酸分子中含有5种官能团 | |
| D. | 1mol迷迭香酸跟H2反应,最多可消耗7molH2 |
分析 由结构简式可确定分子式,分子中含酚-OH、-COOH、-COOC-、C=C,结合酚、羧酸、酯、烯烃的性质来解答.
解答 解:A.含碳碳双键,能使酸性高锰酸钾及溴的四氯化碳溶液褪色,含O元素,则不属于芳香烃,故A不选;
B.由结构简式可知分子式为C18H16O8,含-COOC-可发生水解反应,但不是皂化反应,故B不选;
C.含酚-OH、-COOH、-COOC-、C=C,共4种官能团,故C不选;
D.2个苯环与1个碳碳双键与氢气发生加成反应,则1mol迷迭香酸跟H2反应,最多可消耗7molH2,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重醇、烯烃、羧酸、酯性质的考查,选项B为易错点,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
12.下列说法正确的是( )
| A. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| B. | 向酒精灯内添加酒精时,酒精量不能超过酒精灯容积的2/3,若不慎洒出的酒精在桌上燃烧,应迅速用水浇灭 | |
| C. | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液的红色变浅,则证明Na2CO3溶液中存在水解平衡 | |
| D. | 在“金属析氢腐蚀”的对比实验中,外面缠绕着铜丝的铁钉上产生气泡多,若滴加几滴KSCN溶液,则在铁钉周围出现血红色 |
19.下列离子方程式的书写及评价均合理的是( )
| A. | 将2mol Cl2通入到含1mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2正确;Cl2过量,Fe2+、Br-均被氧化 | |
| B. | 用Cu电极电解NaCl溶液阳极的电极反应式:2Cl--2e-═Cl2↑正确;Cl-优先于OH-放电 | |
| C. | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3-正确;H2SO3的酸性强于HClO | |
| D. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O正确;Mg(OH)2比MgCO3更难溶 |
16.下列关于有机物的说法正确的是( )
| A. | 石油的分馏和裂化均属于化学变化 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 糖类、蛋白质、合成橡胶都是高分子化合物 | |
| D. | 甲苯、乙烯、聚乙烯都能使酸性KMnO4溶液褪色 |
14.降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
则P1>P3 (填“>”“<”或“=”,下同).若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1<K3.T1、P1时H2的平衡转化率为57.14%.
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=122.4kJ•mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示.
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
②一定条件下,上述反应在密闭容器中达平衡.当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是cd.
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,$\frac{c(HC{O}_{3})}{c(C{O}_{3}^{2-})}$增大(填“增大”“不变”或“减小”).用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:b.
a.c(K+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
b.c(HCO3-)>c(CO32-)
c.降低温度,c(H+)•c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为2Fe3++3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑.
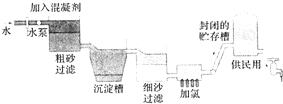 自来水生成流程示意图
自来水生成流程示意图
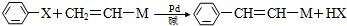 (X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下:
(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下: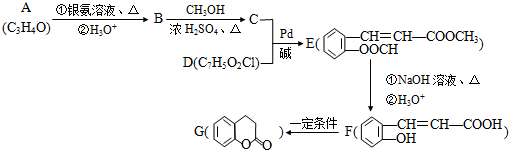
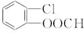 .
.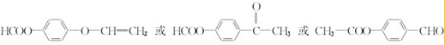 .
. )常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
)常作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(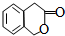 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液. (R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备
(R、R′为烃基).以苯、丙烯(CH2=CH-CH3)为原料,制备 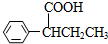 的合成路线流程图如下,请补充完整流程图(无机试剂任选).
的合成路线流程图如下,请补充完整流程图(无机试剂任选).