题目内容
7.X、Y、Z、W是四种常见的短周期主族元素,核电荷数依次增大.X有三种同位素,其中有两种常用于制造氢弹.Y、Z是同周期相邻元素,Y的最简单氢化物常用作致冷剂,Z的一种氢化物分子呈V型结构,其沸点远高于同族其它稳定的氢化物,Z的另一种氢化物M分子中两种元素的原子个数比为1:1;W的最高正价与最低负价的代数和与Z原子的L层电子数相等.请回答下列问题:(1)X元素的名称为氢,Z在周期表中的位置第二周期ⅥA族;
(2)写出X、Y、W形成离子化合物的电子式
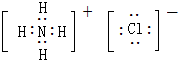 ,Y的最简单氢化物分子呈三角锥型;
,Y的最简单氢化物分子呈三角锥型;(3)Y的最简单氢化物与最高价氧化物对应的水化物形成的盐R,R是一种常见的化肥和炸药,R可以促进水的电离,水溶液显酸性(填“酸”或“碱”),溶液中各种离子浓度的大小顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)写出碳与XYZ3浓溶液反应的离子方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
分析 X、Y、Z、W是四种常见的短周期主族元素,核电荷数依次增大,X有三种同位素,其中有两种常用于制造氢弹,则X为H元素;
Y、Z是同周期相邻元素,Y的最简单氢化物常用作致冷剂为氨气,则Y为N元素,Z的一种氢化物分子呈V型结构,其沸点远高于同族其它稳定的氢化物则Z为O元素;Z的另一种氢化物M分子中两种元素的原子个数比为1:1,M为H2O2;
W的最高正价与最低负价的代数和与Z原子的L层电子数相等6,则W为Cl元素;
(1)X元素的名称为氢,主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,据此判断Z在周期表中的位置;
(2)H、N、Cl形成离子化合物为氯化铵,氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N-H原子之间存在共价键;
Y的最简单氢化物为氨气,氮原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论确定氨气分子构型;
(3)Y的最简单氢化物氨气与最高价氧化物对应的水化物硝酸形成的盐R,为硝酸铵,硝酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,但水解程度较小;
(4)C与HNO3浓溶液在加热条件下反应生成二氧化碳、二氧化氮和水.
解答 解:X、Y、Z、W是四种常见的短周期主族元素,核电荷数依次增大,X有三种同位素,其中有两种常用于制造氢弹,则X为H元素;
Y、Z是同周期相邻元素,Y的最简单氢化物常用作致冷剂为氨气,则Y为N元素,Z的一种氢化物分子呈V型结构,其沸点远高于同族其它稳定的氢化物则Z为O元素;Z的另一种氢化物M分子中两种元素的原子个数比为1:1,M为H2O2;
W的最高正价与最低负价的代数和与Z原子的L层电子数相等6,则W为Cl元素;
(1)X元素的名称为氢,主族元素原子核外电子层数与其周期数相等、最外层电子数与其族序数相等,Z为O元素,O原子核外有2个电子层、最外层电子数是6,所以O元素位于第二周期第VIA族;
故答案为:氢;第二周期ⅥA族;
(2)H、N、Cl形成离子化合物为氯化铵,氯化铵中铵根离子和氯离子之间存在离子键、铵根离子中N-H原子之间存在共价键,其电子式为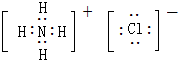 ;
;
Y的最简单氢化物为氨气,氮原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论知氨气分子构型为三角锥形;
故答案为: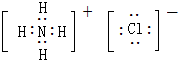 ;三角锥形;
;三角锥形;
(3)Y的最简单氢化物氨气与最高价氧化物对应的水化物硝酸形成的盐R,为硝酸铵,硝酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,c(H+)>c(OH-),但水解程度较小,硝酸根离子不水解,所以溶液中离子浓度大小顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)C与HNO3浓溶液在加热条件下反应生成二氧化碳、二氧化氮和水,反应方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
点评 本题考查位置结构性质相互关系及应用,涉及浓硝酸性质、盐类水解、物质结构及构型判断等知识点,侧重考查学生分析判断能力,难点是价层电子对互斥理论的应用,题目难度不大.

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案| A. | 若M与W组成原子数为1:1、1:2型离子化合物,则W2G的水溶液含7种粒子 | |
| B. | 若W单质在QM2气体中燃烧生成黑色、白色两种固体,则W的原子序数与族序数之比为5 | |
| C. | 若W与G组成的化合物在水中剧烈反应,产生白色沉淀和气体,M与W组成的化合物易升华 | |
| D. | 若M与W组成的化合物作光导纤维材料,则W单质及其氧化物都抗所有酸溶液的腐蚀 |
| A. | 滴入NaOH溶液,有白色沉淀产生,说明雾霾中一定含Mg2+ | |
| B. | 滴入AgNO3溶液,有白色沉淀产生,说明雾霾中一定含Cl- | |
| C. | 滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42- | |
| D. | 加入浓NaOH溶液微热,试管口的湿润红色石蕊试纸变蓝,说明雾霾中一定含NH4+ |
| A. | 铝合金熔点低,可用来制造门窗 | |
| B. | 二氧化氯具有强氧化性,可用来漂白织物 | |
| C. | 过氧化钠固体呈淡黄色,可用来做供氧剂 | |
| D. | 硫酸铜溶于水呈酸性,可用来做杀菌剂 |
| A. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| B. | 向酒精灯内添加酒精时,酒精量不能超过酒精灯容积的2/3,若不慎洒出的酒精在桌上燃烧,应迅速用水浇灭 | |
| C. | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液的红色变浅,则证明Na2CO3溶液中存在水解平衡 | |
| D. | 在“金属析氢腐蚀”的对比实验中,外面缠绕着铜丝的铁钉上产生气泡多,若滴加几滴KSCN溶液,则在铁钉周围出现血红色 |
| A. | 将2mol Cl2通入到含1mol FeBr2的溶液中:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2正确;Cl2过量,Fe2+、Br-均被氧化 | |
| B. | 用Cu电极电解NaCl溶液阳极的电极反应式:2Cl--2e-═Cl2↑正确;Cl-优先于OH-放电 | |
| C. | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3-正确;H2SO3的酸性强于HClO | |
| D. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O正确;Mg(OH)2比MgCO3更难溶 |
| A. | 石油的分馏和裂化均属于化学变化 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 糖类、蛋白质、合成橡胶都是高分子化合物 | |
| D. | 甲苯、乙烯、聚乙烯都能使酸性KMnO4溶液褪色 |
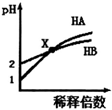
| A. | HB一定是弱酸 | |
| B. | 在x点,c(A-)=c(B-) | |
| C. | 稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 | |
| D. | 取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |