题目内容
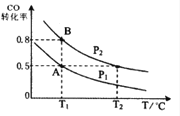
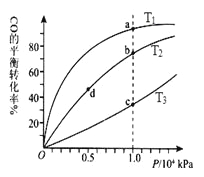
【题目】甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H=-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为_________ 。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= ___ L。
(3)关于反应CO(g)+2H2(g)![]() CH3OH(g)在化学平衡状态时的描述正确的是(填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是(填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2) D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g)![]() CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如上图所示。下列说法正确的是( ) 。
CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如上图所示。下列说法正确的是( ) 。
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) = K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流计的指针发生了偏转。
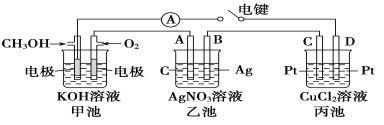
请回答下列问题:
(a)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为____mL(标准状况),丙池中______(填“C”或“D”)极析出_____g铜。
(b)若丙池中电极不变,将其中溶液换成NaCl溶液,开关闭合一段时间后,甲池中溶液的pH将____(填“增大”、“减小”或“不变”,下同);丙池中溶液的pH将________。
【答案】
(1)K=![]()
(2)4
(3)A D
(4) A
(5)(a) 280 D 1.60 (b)减小 增大
【解析】
试题分析:(1)该反应的化学平衡常数表达式为K=![]() 。
。
(2)
CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g )
CH3OH ( g )
开始 10 20 0
转化 5 10 5
平衡 5 10 5
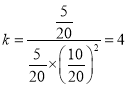
CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g )
CH3OH ( g )
开始 10 20 0
转化 8 16 8
平衡 2 4 8
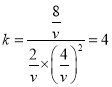 V=4
V=4
(3)关于反应CO(g)+2H2(g)![]() CH3OH(g)在化学平衡状态时的描述正确的是(填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是(填字母)。
根据平衡定义,CO的含量保持不变,一定平衡; CH3OH浓度与CO浓度相等,不一定平衡;正逆反应速率比等于系数比一定达到平衡状态 ,2V正(CH3OH)=V正(H2)不一定平衡;气体物质的量是变量,![]() ,容器中混合气体的平均相对分子质量是变量,保持不变一定平衡。
,容器中混合气体的平均相对分子质量是变量,保持不变一定平衡。
(4)焓变<0,升高温度,平衡逆向移动,CO的转化率降低,温度:T1 < T2 <T3 ;正反应速率:温度越高速率越大,ν(a)<ν(c); 压强越大速率越大,ν(b)>ν(d)平衡常数:升高温度,平衡逆向移动,K(a) > K(c) ;温度相同平衡常数相同 K(b) =K(d);
升高温度,平衡逆向移动,气体物质的量增大,平均摩尔质量减小:M(a)>M(c);增大压强,平衡正向移动,平均摩尔质量增大,M(b)>M(d)
(5)当闭合该装置的开关时,甲池是原电池;乙池、丙池是电解池。 (a)当乙池中B极质量增加5.40 g时,转移电子0.05mol,甲池中理论上消耗O2 0.0125mol,体积为280mL(标准状况),丙池中D是阴极, D极析出0.025mol铜,质量是1.60g。
(b)若丙池中电极不变,将其中溶液换成NaCl溶液,开关闭合一段时间后,甲池中总反应是![]() ,消耗氢氧化钾,溶液的pH将减小,丙池中总反应是
,消耗氢氧化钾,溶液的pH将减小,丙池中总反应是![]() ,溶液的pH将增大。
,溶液的pH将增大。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案