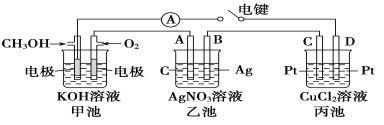
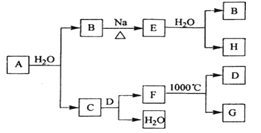
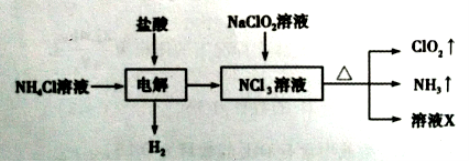
题目内容
【题目】分类是化学学习与研究的常用方法,下列分类正确的是
A.Cl2O7、P2O5、SO3、CO2均属于酸性氧化物
B.Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
【答案】A
【解析】
试题分析:A、Cl2O7、P2O5、SO3、CO2均属于酸性氧化物,正确;B、Na2O2不属于碱性氧化物,错误;C、根据分散质微粒直径大小不同,将分散系分为溶液、浊液和胶体,错误;D、根据电解质在水溶液中的电离程度,将电解质分为强电解质、弱电解质,错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目