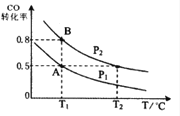
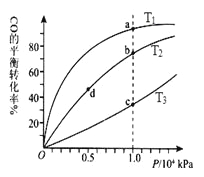
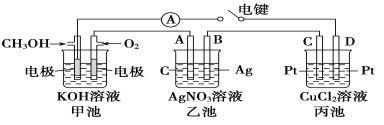
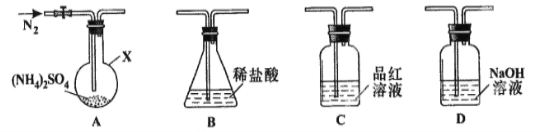
题目内容
【题目】常温下,饱和NaClO溶液的pH约为11。某消毒液的主要成分为NaClO,洁厕灵主要成分为HCl。下列解释相关事实的离子方程式中不合理的是
A.该消毒液加白醋生成HClO,可增强消毒能力:H++ClO-=HClO
B.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
C.常温下,该消毒液的pH≈11,是因为:ClO-+H2O![]() HClO+OH-
HClO+OH-
D.该消毒液与洁厕灵混用会引起中毒:2H++Cl-+ClO-=Cl2↑+H2O
【答案】 A
【解析】
试题分析:A.由于HClO酸性较弱,则NaClO可与醋酸反应生成HClO,漂白性增强,但醋酸是弱电解质,应是化学式,正确的离子方程式为:CH3COOH+ClO-═HClO+CH3COO-,该离子方程式不合理,故A错误;B.该消毒液可用NaOH溶液吸收Cl2制备,反应的离子方程式为:Cl2+2OH-→ClO-+Cl-+H2O,该解释合理,故B正确;C.饱和NaClO溶液的pH约为11,是由ClO-的水解为溶液呈碱性的主要原因,故C正确;D.在酸性条件下与氯离子发生氧化还原反应生成氯气,发生反应为:2H++Cl-+ClO-═Cl2↑+H2O,该反应合理,故D正确;故答案为A。

练习册系列答案
相关题目