题目内容
【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________。
(2)已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
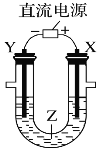
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
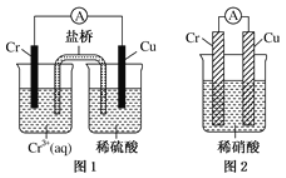
① ____________________________________。
② ____________________________________。
【答案】2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H =-130.98 kJ·mol1 +236 2mol 8mol 80% 金属铬的活泼性比铜强且能和稀硫酸反应生成H2 金属铬易被稀硝酸钝化
【解析】
(1)根据盖斯定律计算;
(2)根据焓变等于反应物的总键能减去生成物的总键能进行计算;
(3)依据化学平衡三段式列式计算;
(4)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,能和稀硫酸反应生成H2;而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr和硝酸能产生钝化现象。
(1)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJmol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJmol-1
③H2O(l)=H2O(g)△H=+88.0kJmol-1
依据盖斯定律:①+②-③得:
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98 kJmol-1;
(2) △H=反应物的总键能-生成物的总键能=4×360+2×436-2×176-4×431=+236(kJ·mol-1)
(3)向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2molL-1,H2 0.8molL-1,CH4 0.8molL-1,H2O 1.6molL-1 ,起始充CO2和H2的物质的量分别为x、y;
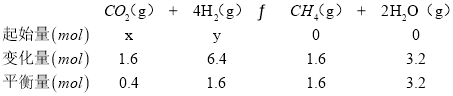
x=1.6mol+0.4mol=2mol,y=6.4mol+1.6mol=8mol;
CO2的平衡转化率=![]() ×100%=80%;
×100%=80%;
(4)由图1可知还原性Cr>Cu,但在稀硝酸中却出现了反常,结合稀硝酸的氧化性,不难推测铬被稀硝酸钝化,导致活性降低,
故答案为:①金属铬的活泼性比铜强且能和稀硫酸反应生成H2;②金属铬易被稀硝酸钝化。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案