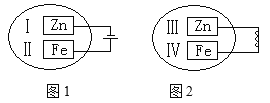题目内容
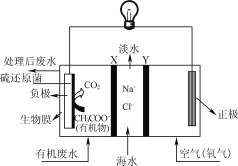
【题目】用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是
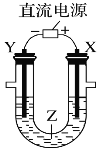
A. 氯碱工业中,X电极上反应式是4OH--4e-=2H2O+O2↑
B. 电解精炼铜时,Z溶液中的铜离子浓度不变
C. 在铁片上镀铜时,Y是纯铜
D. 电解水制氢气时,Z可以是稀硫酸溶液
【答案】D
【解析】
由示意图可知,与电源负极相连的Y电极为阴极,阴极上发生还原反应,与电源正极相连的X电极为阳极,阳极上发生氧化反应。
A项、氯碱工业中,X电极连接电源正极,为电解池的阳极,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,故A错误;
B项、电解精炼粗铜时,阳极上Cu和其它活性金属失电子发生氧化反应,阴极上Cu2+得电子,根据转移电子守恒知,阳极上溶解Cu的质量小于阴极析出Cu的质量,所以溶液中Cu2+浓度变小,故B正确;
C项、电镀时,镀层作阳极、镀件作阴极,在铁片上镀铜时,铁片做阴极为Y电极,铜做阳极为X电极,故C错误;
D项、电解稀硫酸溶液实质上是电解水,阴极上是氢离子得电子的还原反应,在阳极上是氢氧根离子失电子的氧化反应,故D正确。
故选D。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________。
(2)已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
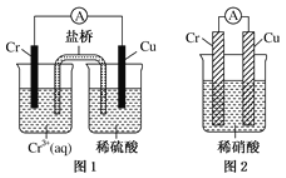
① ____________________________________。
② ____________________________________。
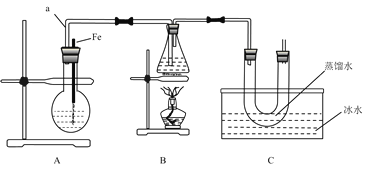
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
己知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1) B中发生反应生成目标产物的化学方程式为_________。
(2)根据实验目的,选择下列合适的实验步骤:①→___________(选填②③④等)。
①组装好装置,___________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加入冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_____。
(4)冰水的作用是_______。
(5)反应完毕后,U形管内的现象是______________;分离溴乙烷时所需的玻璃仪器有_____。