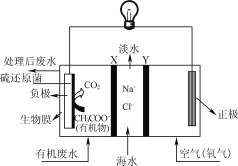
题目内容
【题目】今有化合物:
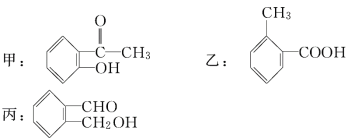
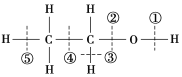
(1)请写出丙中含氧官能团的名称:_____________________。
(2)请判别上述哪些化合物互为同分异构体:________________________________。
(3)请分别写出鉴别甲的方法。(指明所选 试剂及主要现象即可)鉴别甲的方法:____________________________
(4)请按酸性由强至弱排列甲、乙、丙的顺序:________________。
【答案】羟基、醛基 甲乙丙 FeCl3溶液出现紫色 乙甲丙
【解析】
(1)依据官能团的命名作答;
(2)分子式相同,结构不同的有机物互为同分异构体;
(3)甲中含酚羟基,酚羟基遇FeCl3显紫色,据此鉴别。
(4)酸性比较:羧酸大于酚羟基,酚羟基大于醇羟基,据此分析作答。
(1)丙含有的官能团为醛基和羟基,故答案为:羟基、醛基;
(2)甲、乙、丙分子式都为C8H8O2,但结构不同,主要是官能团不同,互为同分异构体,故答案为:甲、乙、丙;
(3)鉴别甲可利用氯化铁溶液鉴别,其溶液显紫色,故答案为:FeCl3溶液出现紫色;
(4)甲中含酚羟基具有弱酸性,酸性弱于羧酸;乙中含羧基;丙中含羟基与醛基均无酸性,则酸性比较:乙甲丙。

【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________。
(2)已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
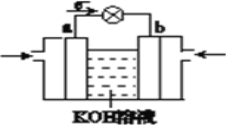
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
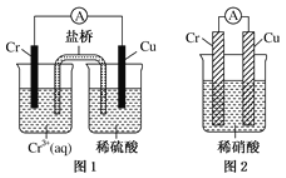
① ____________________________________。
② ____________________________________。