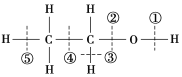
题目内容
【题目】已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O △H<0
Cr2O72-+H2O △H<0
(1)该反应平衡常数的表达式为_______________________
(2)下列说法正确的是_________
A、V正(CrO42—)=2V逆(Cr2O72—)说明该反应已达平衡状态
B、溶液颜色不变说明该反应已达平衡状态
C、溶液中c(CrO42—):c(Cr2O72—)=2:1时该反应已达平衡状态
D、升温该反应平衡常数变大
E、向平衡后的体系中加入一定量的水,平衡不移动
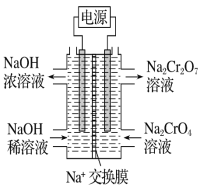
(3)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置(两极均为惰性电极)电解Na2CrO4 溶液制取Na2Cr2O7图中右侧电极连接电源的______极,其电极反应式为______________
Cr2O72-+H2O设计图示装置(两极均为惰性电极)电解Na2CrO4 溶液制取Na2Cr2O7图中右侧电极连接电源的______极,其电极反应式为______________
(4)H+(aq)+OH-(aq)=H2O(l);ΔH= -a KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH= -b KJ/mol
2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l);ΔH= -c KJ/mol
Cr2O72-(aq)+H2O(l);ΔH= -c KJ/mol
已知酸性条件下Cr2O72—将Cl-氧化为Cl2,本身被还原为Cr3+,试写出该反应的热化学方程式:_______________________________________________________________
【答案】![]() AB 正 2H2O-4e-= O2↑+4H+或4OH--4e-= O2↑+2H2O Cr2O72-(aq)+6Cl-(aq)+14H+(aq)=3Cl2(g)+2Cr3(aq)++7H2O(l) ΔH=(c+b-16a)kJ/mol
AB 正 2H2O-4e-= O2↑+4H+或4OH--4e-= O2↑+2H2O Cr2O72-(aq)+6Cl-(aq)+14H+(aq)=3Cl2(g)+2Cr3(aq)++7H2O(l) ΔH=(c+b-16a)kJ/mol
【解析】
(1)化学平衡常数等于生成物浓度幂之积比上反应物浓度幂之积;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)根据平衡2CrO42-+2H+![]() Cr2O72-+H2O可知制取Na2Cr2O7时,需要通过电解提高溶液的酸性,使平衡正向移动,则右侧电极是电解池的阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
Cr2O72-+H2O可知制取Na2Cr2O7时,需要通过电解提高溶液的酸性,使平衡正向移动,则右侧电极是电解池的阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O;
(4)根据盖斯定律分析计算。
(1)化学平衡常数等于生成物浓度幂之积比上反应物浓度幂之积,则K=![]() ,故答案为:K=
,故答案为:K=![]() ;
;
(2)A、V正(CrO42-)=2V逆(Cr2O72-),速率之比等于对应物质的量之比,说明该反应已达平衡状态,故正确;
B、溶液颜色不变说明各物质的浓度不变,该反应已达平衡状态,故B正确;
C、溶液中c(CrO42-):c(Cr2O72-)=2:1,但不是浓度不变的状态,故C错误;
D、升温该反应平衡常数变大,与是否平衡无关,故D错误;
E、向平衡后的体系中加入一定量的水,平衡不移动,与平衡状态无关,故E错误;
AB正确,故答案为:AB;
(3)根据平衡可知制取Na2Cr2O7,需要提高右侧溶液的酸性,使平衡正向移动,则右侧电极是电解池的阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O,故答案为:正;4OH--4e-=O2↑+2H2O;
(4)将已知热化学方程式依次编号为①②③,根据盖斯定律①×16-②-③得:Cr2O72-(aq)+6Cl-(aq)+14H+(aq)=3Cl2(g)+2Cr3(aq)++7H2O(l),则△H=△H1—△H2—△H3=(c+b-16a)kJ/mol,故答案为:Cr2O72-(aq)+6Cl-(aq)+14H+(aq)=3Cl2(g)+2Cr3(aq)++7H2O(l)△H=(c+b-16a)kJ/mol。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________。
(2)已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
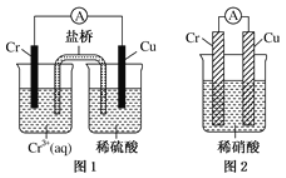
① ____________________________________。
② ____________________________________。