题目内容
1.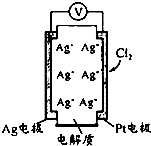 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )| A. | 电子经外电路流向Pt电极 | |
| B. | 正极反应:Cl2+2e-+2Ag+=2AgCl | |
| C. | 电池工作时,电解质中Ag+数目减少 | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
分析 Ag电极为负极发生氧化反应生成银离子,氯气在正极发生还原反应生成氯离子,氯离子与银离子反应生成AgCl沉淀,据沉淀质量测定氯气含量,据此分析.
解答 解:Ag电极为负极发生氧化反应生成银离子,氯气在正极发生还原反应生成氯离子,
A、电子从负极流向正极Pt,故A正确;
B、氯气在正极发生还原反应生成氯离子,氯离子与银离子反应生成AgCl沉淀,反应为:Cl2+2e-+2Ag+=2AgCl,故B正确;
C、Ag电极为负极发生氧化反应生成银离子,氯气在正极发生还原反应生成氯离子,氯离子与银离子反应生成AgCl沉淀,所以电池工作时,电解质中Ag+数目不变,故C错误;
D、反应原理是Ag与氯气反应,所以空气中c(Cl2)越大,Ag极消耗速率越快,故D正确;
故选C.
点评 本题考查了原电池原理的应用,注意电解反应类型和电子移动方向,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
12.臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)?N2O5(g)+O2(g).若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )
| A. | B. | C. | D. |
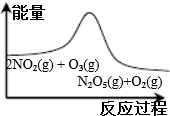 | 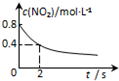 |  | 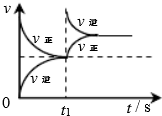 |
| 平衡后升温, NO2含量降低 | 0~2s内, v(O3)=0.2 mol•L-1•s-1 | V正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | A | B. | B | C. | C | D. | D |
6.室温下,下列溶液中粒子浓度大小关系正确的是( )
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① | |
| C. | 0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 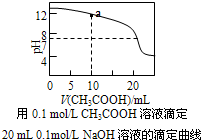 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
10.下列物质间的反应,其能量变化符合如图的是( )
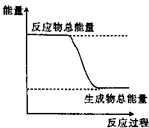

| A. | 灼热的碳和二氧化碳的反应 | B. | Ba (OH)2•8H2O晶体和NH4Cl晶体混合 | ||
| C. | 生石灰和水反应 | D. | CaCO3分解 |
 ,CaCl2
,CaCl2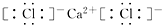 ,NaOH
,NaOH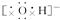 Na2O2
Na2O2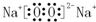 .
.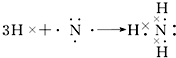 ;
;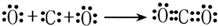 .
.
 氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知:
氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.氮化铝产品中往往含有炭和氧化铝杂质.化学研究性学习小组为测定该产品中氮化铝的质量分数,取一定量的氮化铝产品,进行以下实验.已知: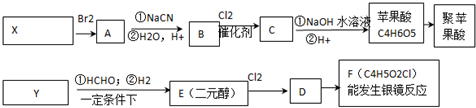
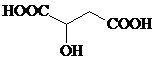 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$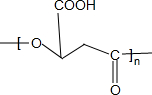 +nH2O;
+nH2O;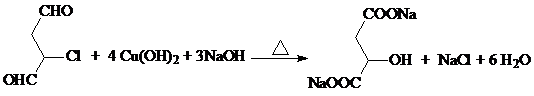 +2Cu2O↓.
+2Cu2O↓. .
.