题目内容
1.(1)用电子式表示下列物质:CH4 ,CaCl2
,CaCl2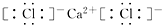 ,NaOH
,NaOH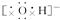 Na2O2
Na2O2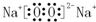 .
.(2)用电子式表示下列物质的形成过程.
NH3:
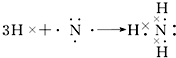 ;
;CO2:
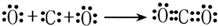 .
.
分析 (1)甲烷中碳原子分别于4个氢原子形成共用电子对;
CaCl2是钙离子与2个氯离子通过离子键结合;
NaOH为离子化合物,钠离子与氢氧根离子之间通过离子键结合,氧原子与氢原子之间存在H-O键;
过氧化钠中两个氧原子通过共用电子对结合,两个钠离子与过氧根离子通过离子键结合;
(2)氨气和二氧化碳均为共价化合物,根据共价化合物电子式的表示方法用电子式表示出氨气和CO2的形成过程.
解答 解:(1)碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为 ;
;
CaCl2是钙离子与2个氯离子通过离子键结合,电子式为: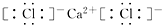 ;
;
NaOH中钠离子与氢氧根离子之间通过离子键结合,氧原子与氢原子之间存在H-O键,电子式为:Na+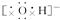 ;
;
过氧化钠为离子化合物,2个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用电子对结合,电子式为: ;
;
故答案为: ;
;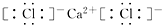 ;
;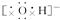 ;
;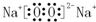 ;
;
(2)用电子式表示氨气分子的形成过程为:3H•+ →
→ ,二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为:
,二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为: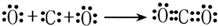 ,
,
故答案为:3H•+ →
→ ;
; 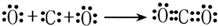 .
.
点评 本题主要考查常见物质电子式的书写以及用电子式表示常见物质的形成过程,题目难度中等,明确电子式的概念及表示方法为解答关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
11.下列实验操作或所记录的数据合理的是( )
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 用pH试纸无法测得某氯水的pH值,因为氯水具有漂白性 | |
| D. | SO2能使紫色KMnO4溶液褪色,是由于其具有漂白性 |
12.下列事实和平衡移动无关的是( )
| A. | 开启啤酒后,瓶中立刻泛起大量泡沫 | |
| B. | 实验室中常用排饱和食盐水的方法收集Cl2 | |
| C. | 合成氨工业中不断分离出液氨有利于NH3的生成 | |
| D. | 氯化亚铁溶液久置呈黄色 |
9.下列实验能获得成功的是( )
| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与浓溴水反应制取溴苯 | |
| C. | 向苯酚中加浓溴水观察沉淀 | |
| D. | 1 mol/L CuSO4溶液 2 mL和0.5 mol/L NaOH溶液4 mL 混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
16.下列表示离子化合物形成过程的电子式正确的是( )
| A. | 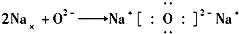 | B. | 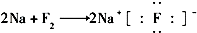 | ||
| C. | 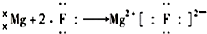 | D. | 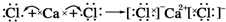 |
6.下列说法正确的是( )
| A. | 同一元素各核素的质量数不同,但它们的化学性质几乎完全相同 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子构成的 | |
| C. | 钠原子失去一个电子后,它的电子数与氖原子相同,变成10e-微粒 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们互为同位素 |
20.下列说法正确的是( )
| A. | 氯化铵受热固体消失和干冰升华只需克服分子间作用力 | |
| B. | NaF、H2SO4中所含化学键类型相同 | |
| C. | HCl气体溶于水和NaOH熔化破坏的化学键类型相同 | |
| D. | I2、Br2、Cl2、F2 熔沸点逐渐降低 |
1.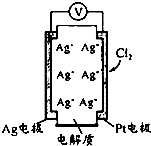 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )| A. | 电子经外电路流向Pt电极 | |
| B. | 正极反应:Cl2+2e-+2Ag+=2AgCl | |
| C. | 电池工作时,电解质中Ag+数目减少 | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
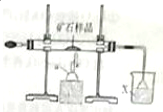 下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:
下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图: