题目内容
10.下列物质间的反应,其能量变化符合如图的是( )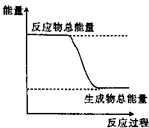
| A. | 灼热的碳和二氧化碳的反应 | B. | Ba (OH)2•8H2O晶体和NH4Cl晶体混合 | ||
| C. | 生石灰和水反应 | D. | CaCO3分解 |
分析 从图上分析,反应物能量高于生成物,正反应是放热反应,常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、多数的化合反应等.常见的吸热反应:Ba(OH)2•8H2O与NH4Cl晶体混合反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等据此分析.
解答 解:A、灼热的碳和二氧化碳的反应,是以C作为还原剂的反应,反应吸热,故A错误;
B、Ba(OH)2•8H2O与NH4Cl晶体混合反应是吸热反应,故B错误;
C、生石灰和水反应,属于化合反应,是放热反应,故C正确;
D、碳酸钙分解属于分解反应,是吸热反应,故D错误;
故选:C.
点评 本题通过反应物与生成物能量不同判断放热反应和吸热反应,并熟悉常见的放热反应和吸热反应.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
20.下列说法正确的是( )
| A. | 氯化铵受热固体消失和干冰升华只需克服分子间作用力 | |
| B. | NaF、H2SO4中所含化学键类型相同 | |
| C. | HCl气体溶于水和NaOH熔化破坏的化学键类型相同 | |
| D. | I2、Br2、Cl2、F2 熔沸点逐渐降低 |
1.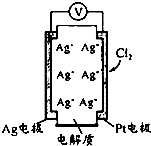 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体物质.下列分析不正确的是( )| A. | 电子经外电路流向Pt电极 | |
| B. | 正极反应:Cl2+2e-+2Ag+=2AgCl | |
| C. | 电池工作时,电解质中Ag+数目减少 | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
18.已知KClO3+5KCl+3H2SO4=3K2SO4+3Cl2↑+3H2O,下列说法不正确的是( )
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 1 mol KClO3参加反应时有10 mol电子转移 |
5.X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为( )
| A. | HX | B. | H2X | C. | XH4 | D. | XH3 |
2.按下列路线制聚氯乙烯,未发生的反应类型是( )
C2H5Br→CH2=CH2→C1H2C-CH2Cl→CH2=CHCl→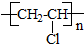
C2H5Br→CH2=CH2→C1H2C-CH2Cl→CH2=CHCl→
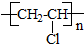
| A. | 消去反应 | B. | 取代反应 | C. | 加成反应 | D. | 加聚反应 |
19.仅用提供的硅酸盐仪器(非硅酸盐仪器任选),不能达到相应实验目的是( )
| A. | 提纯粗盐:烧杯、玻璃棒、酒精灯、蒸发皿 | |
| B. | 除去CO2气体中混有的少量HCl:导管、洗气瓶 | |
| C. | 用CCl4提取碘水中的碘:分液漏斗、烧杯 | |
| D. | 用18.4 mol•L-1浓硫酸配制100mL 1.0 mol•L-1硫酸:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
20.下列与有关非金属元素叙述以及推理结果不正确的是( )
| A. | 非金属性Cl>Br,故将Cl2通入NaBr溶液中,发生反应为:Cl2+2Br-=Br2+2Cl- | |
| B. | 非金属性F>Br,故酸性:HF>HBr | |
| C. | 非金属性S>33As,故前者的气态氢化物稳定性更强 | |
| D. | 非金属性O>N,故O2与H2化合比N2更容易 |
 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.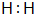
 NH4++OH-.
NH4++OH-.