题目内容
9.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | NaH2PO4水溶液呈酸性,其溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(PH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| D. | O.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 A.NaH2PO4水溶液呈酸性,说明H2PO4-的电离程度大于其水解程度,则c(HPO42-)>c(H3PO4);
B.醋酸的电离程度大于醋酸根离子的水解,溶液显示碱性,则c(CH3COO-)>c(Na+)>c(CH3COOH);
C.根据混合液中的电荷守恒判断;
D.根据该混合液中的物料守恒分析.
解答 解:A.钠离子不水解,浓度最大,H2PO4-电离程度大于其水解程度,溶液呈酸性,电离程度和水解程度都较小,所以溶液中离子浓度大小为:c(Na+)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4),故A错误;
B.O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(pH<7),说明醋酸的电离程度大于醋酸根离子水解程度,故溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+),故B错误;
C.O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合,根据电荷守恒可得:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),故C正确;
D.0.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合,根据物料守恒可得:$\frac{3}{4}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电解质溶液中电离程度与水解程度大小为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
20.既可以鉴别乙烷和乙烯,又可以用来除去乙烷中的乙烯的方法是( )
| A. | 通过足量NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni粉催化、加热条件下通入H2 | D. | 通入足量的KMnO4 酸性溶液 |
17.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键 范德华力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 范德华力 | D. | 范德华力 氢键 非极性键 |
14.我国最新报道的高温超导体中,铊(Ti)是组成的成分之一,已知铊与铝是同族元素,关于铊的性质的判断可能错误的是( )
| A. | 是银白色、质软的金属 | |
| B. | 阳离子氧化性比铝离子强 | |
| C. | 加热蒸干TiCl3溶液可得到无水TiCl3 | |
| D. | 与稀硝酸作用生成硝酸盐 |
8.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ne(填具体元素符号);非金属性最强的元素是F(填具体元素符号),原子结构示意图为 .元素⑩名称为溴.
.元素⑩名称为溴.
(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)在这些元素中,最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是②(填编号)
(5)⑥⑦⑧⑨四种元素对应的简单离子中,离子半径最小的是Al3+(填离子符号)
(6)⑧和⑨都是重要的非金属元素.下列叙述中,能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧
b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质
d.⑨的氢化物的酸性比⑧的氢化物的酸性强.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
 .元素⑩名称为溴.
.元素⑩名称为溴.(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)在这些元素中,最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是②(填编号)
(5)⑥⑦⑧⑨四种元素对应的简单离子中,离子半径最小的是Al3+(填离子符号)
(6)⑧和⑨都是重要的非金属元素.下列叙述中,能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧
b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质
d.⑨的氢化物的酸性比⑧的氢化物的酸性强.
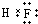 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.
