题目内容
20.既可以鉴别乙烷和乙烯,又可以用来除去乙烷中的乙烯的方法是( )| A. | 通过足量NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni粉催化、加热条件下通入H2 | D. | 通入足量的KMnO4 酸性溶液 |
分析 乙烯含有C=C官能团,能与溴水发生加成反应,能被酸性高锰酸钾溶液氧化,注意除杂时不能引入新的杂质,且不能影响被提纯的物质.
解答 解:A.二者都不与氢氧化钠反应,不能鉴别,故A错误;
B.通入溴水中,乙烯与溴水发生加成反应生成二溴乙烷,溴水褪色,既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯,故B正确;
C.因不能确定乙烯的含量,不能确定通入氢气的量,易引入杂质,且不能鉴别二者,故C错误;
D.通入酸性高锰酸钾溶液中,但是生成二氧化碳气体,引入新的杂质,故D错误.
故选B.
点评 本题考查有机物的鉴别和除杂问题,题目难度不大,注意乙烷和乙烯的性质的异同,注意乙烯与酸性高锰酸钾反应生成二氧化碳的性质.

练习册系列答案
相关题目
10.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,有良好的超导性.下列关于K3C60的组成和结构分析正确的是( )
| A. | K3C60中既有离子键,又有共价键 | |
| B. | 1molK3C60中含有的离子数目为63×6.02×1023 | |
| C. | 通常条件下该晶体有良好的导电性 | |
| D. | 该物质的化学式可写为KC20 |
15.下列说法正确的是( )
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
5.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 |
12.利用海水制备部分物质的流程图如下.下列有关说法正确的是( )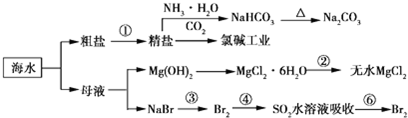

| A. | 电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用 | |
| B. | 联合制碱法最终副产物为氯化铵,原子利用率小于100% | |
| C. | 步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁 | |
| D. | 海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程 |
9.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | NaH2PO4水溶液呈酸性,其溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(PH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| D. | O.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
19.某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质.为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去).下列说法的是( )
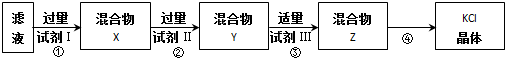

| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |
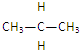 和
和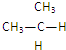 互为同位素的是②,互为同素异形体的是①,互为同系物的是④,互为同分异构体的是③,其名称分别为正丁烷、异丁烷,互为同一物质的是⑤.
互为同位素的是②,互为同素异形体的是①,互为同系物的是④,互为同分异构体的是③,其名称分别为正丁烷、异丁烷,互为同一物质的是⑤. ,一个-CH2-和一个-Cl,它可能的结构简式是CH3C(CH3)2CH2Cl.(任意写出一种)
,一个-CH2-和一个-Cl,它可能的结构简式是CH3C(CH3)2CH2Cl.(任意写出一种)