题目内容
7.雾霾已成为社会备受关注的焦点,它不仅含有悬浮颗粒物,还存在SO2和NO2.某校化学兴趣小组针对大气污染物的治理进行了积极的探究.

方法一:利用氨水可以将SO2和NO2吸收,原理如图1所示;
(1)NO2被吸收的离子方程式是4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,.
方法二:利用如图2 装置(惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2.
(2)①左池在通入SO2气体的同时还要添加稀硫酸,目的是增大溶液导电能力,阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为N2,对于S2O42-转化什么物质,同学们结合高中知识,认为只有以下三种假设,请完成假设二和假设三.
假设一:只生成了SO32-;
假设二:只生成了SO42-;
假设三:生成了SO32-或SO42-;
请你设计实验验证上述假设一,完成下表中内容(可供选择的药品有稀H2SO4、稀HCl、HNO3、MgCl2、BaCl2、酚酞、品红等).
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
分析 (1)根据流程图知,NO2被NH4HSO3吸收生成N2,NO2得电子被还原,则HSO3-被氧化生成SO42-,据此书写离子方程式;
(2)①根据图片知,左池中二氧化硫失电子和水反应生成硫酸,为增大导电能力,应该还加入稀硫酸;
②碱性条件下,NO2和S2O42-反应时得电子作氧化剂,则S2O42-失电子作还原剂,根据高中知识知,如果S2O42-作还原剂,可能被氧化为SO32-或SO42-或二者都有;
SO32-能和稀硫酸反应生成SO2,SO2具有漂白性,能使品红溶液褪色.
解答 解:(1)根据流程图知,NO2被NH4HSO3吸收生成N2,N元素化合价由+4价变为0价,NO2得电子被还原,则HSO3-失电子被氧化,被氧化生成SO42-,离子方程式为4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,故答案为:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,;
(2)①根据图片知,S元素化合价由+4价变为+6价,所以左池电极是阳极,则左池中SO2失电子和水反应生成硫酸,水溶液导电能力较弱,为增大导电能力,应该还加入稀硫酸,电极反应式为SO2+2H2O-2e-=SO42-+4H+,故答案为:稀硫酸;增大溶液导电能力;SO2+2H2O-2e-=SO42-+4H+;
②碱性条件下,NO2和S2O42-反应时得电子作氧化剂,则S2O42-失电子作还原剂,根据高中知识知,如果S2O42-作还原剂,可能被氧化为SO32-或SO42-或二者都有;
SO32-能和稀硫酸反应生成SO2,能和有色物质反应生成无色物质而具有漂白性,所以二氧化硫能使品红溶液褪色,其实验方案、预期实验结果和结论为:
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用稀硫酸和得到的溶液制取二氧化硫,再将二氧化硫通入品红溶液中 | 如果品红溶液褪色就说明为亚硫酸根离子,否则不是亚硫酸根离子 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用稀硫酸和得到的溶液制取二氧化硫,再将二氧化硫通入品红溶液中 | 如果品红溶液褪色就说明为亚硫酸根离子,否则不是亚硫酸根离子 |
点评 本题考查探究物质的组成、电解原理、氧化还原反应等知识点,侧重考查学生实验操作、实验设计、获取信息利用信息能力,明确物质的性质是解本题关键,难点是(2)题的性质实验方案设计,注意化学用语的正确运用,题目难度中等.

| A. | NaH2PO4水溶液呈酸性,其溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(PH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| D. | O.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |

| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |

| A. | X能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其褪色原理相同 | |
| B. | Y与乙酸反应生成W的反应类型是取代反应 | |
| C. | Z和Y分子中官能团不同 | |
| D. | W的分子式为C4H8O2 |
| A. | 溶液中n(KCl)=n(KClO)+5n(KClO3) | |
| B. | 参加反应的氯气的物质的量一定为0.15mol | |
| C. | 若反应中转移电子为nmol,则0.15mol<n<0.25mol | |
| D. | 共存体系溶液中,n(K+)、n(Cl-)可能为7:3 |
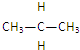 和
和 互为同位素的是②,互为同素异形体的是①,互为同系物的是④,互为同分异构体的是③,其名称分别为正丁烷、异丁烷,互为同一物质的是⑤.
互为同位素的是②,互为同素异形体的是①,互为同系物的是④,互为同分异构体的是③,其名称分别为正丁烷、异丁烷,互为同一物质的是⑤.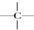 ,一个-CH2-和一个-Cl,它可能的结构简式是CH3C(CH3)2CH2Cl.(任意写出一种)
,一个-CH2-和一个-Cl,它可能的结构简式是CH3C(CH3)2CH2Cl.(任意写出一种)
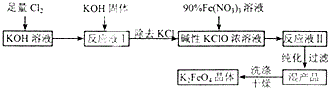 高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:
高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下: