题目内容
1.在完全满足可逆反应:2H2O(g)?2H2(g)+O2(g),2CO(g)+O2(g)?2CO2(g)能顺利进行的条件下,将2 mol H2O(g)和2 mol CO充入2L密闭容器中,使其发生反应.(1)当上述两个反应达到平衡时,至少要知道两种气体的平衡浓度才能计算出平衡时混合物的组成,但这两种气体不能同时是H2O(填化学式,下同)和H2,或CO和CO2.
(2)在某温度下,上述两个反应达到平衡,若O2和CO2的物质的量分别为0.2 mol和1 mol,则此时上述两个反应的平衡常数分别为多少?H2O(g)的转化率为多少?
分析 (1)两个反应靠O2联系起来,只要知道O2和另外任意一种气体的平衡浓度,均可求出混合气体的平衡组成;
(2)二氧化碳浓度为0.5mol/L,则消耗氧气0.25mol,消耗一氧化碳浓度为0.5mol/L,水分解生成氧气总浓度为0.25+0.1=0.35mol/L,根据化学平衡三段式列式计算,
2H2O(g)?2H2(g)+O2(g),
起始量(mol/L) 1 0 0
变化量(mol/L) 0.7 0.7 0.35
平衡量(mol/L) 0.3 0.7 0.1
2CO(g)+O2(g)?2CO2(g)
起始量(mol/L) 1 0.35 0
变化量 (mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.1 0.5
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
H2O(g)的转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:(1)由两个方程式可知,两个反应靠O2联系起来,只要知道O2和另外任意一种气体的平衡浓度,均可求出混合气体的平衡组成,当知道H2O和H2或CO和CO2的平衡浓度时,由于两个方程式无法通过O2建立反应量的关系,所以无法求其混合气体的平衡组成,因而不能是这两组,
故答案为:H2O;H2;CO;CO2;
(2)二氧化碳浓度为0.5mol/L,则消耗氧气0.25mol,消耗一氧化碳浓度为0.5mol/L,水分解生成氧气总浓度为0.25+0.1=0.35mol/L,则
2H2O(g)?2H2(g)+O2(g),
起始量(mol/L) 1 0 0
变化量(mol/L) 0.7 0.7 0.35
平衡量(mol/L) 0.3 0.7 0.1
2CO(g)+O2(g)?2CO2(g)
起始量(mol/L) 1 0.35 0
变化量 (mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.1 0.5
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
反应 2H2O(g)?2H2(g)+O2(g)的平衡常数K=$\frac{0.1×0.{7}^{2}}{0.{3}^{2}}$=0.54,
反应2CO(g)+O2(g)?2CO2(g)的平衡常数K=$\frac{0.{5}^{2}}{0.{5}^{2}×0.1}$=10,
H2O(g)的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.7mol/L}{1mol/L}$×100%=70%,
答:则此时上述两个反应的平衡常数分别为0.54、10;H2O(g)的转化率为70%.
点评 本题考查了化学平衡的影响因素分析判断,平衡常数、转化率概念的计算应用,掌握概念实质是解题关键,题目难度中等.

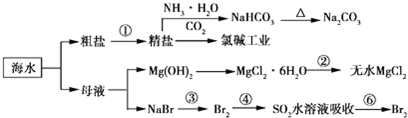
| A. | 电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用 | |
| B. | 联合制碱法最终副产物为氯化铵,原子利用率小于100% | |
| C. | 步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁 | |
| D. | 海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程 |
| A. | NaH2PO4水溶液呈酸性,其溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(PH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| D. | O.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| A. | 化学反应速率通常用单位时间内反应物或生成物的物质的量浓度变化来表示 | |
| B. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 若某化学反应的反应速率为0.5mol/(L•s),就是指在1s内反应物和生成物的浓度变化都为0.5mol/L |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |

| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |