题目内容
19.选择恰当的试剂和方法除去下列物质中的少量杂质(括号内为杂质)(1)C2H6(C2H4)试剂溴水,方法:洗气.
(2)溴苯(溴)试剂NaOH溶液,方法:分液.
(3)苯(甲苯)试剂酸性高锰酸钾溶液,方法:分液.
分析 (1)乙烯与溴水反应,而乙烷不能;
(2)溴与NaOH溶液反应后,与溴苯分层;
(3)甲苯能被高锰酸钾氧化生成苯甲酸,苯甲酸溶于水,与苯分层.
解答 解:(1)乙烯与溴水反应,而乙烷不能,则选择除杂试剂为溴水,方法为洗气,故答案为:溴水;洗气;
(2)溴与NaOH溶液反应后,与溴苯分层,则除杂试剂为NaOH溶液,方法为分液,故答案为:NaOH溶液;
(3)甲苯能被高锰酸钾氧化生成苯甲酸,苯甲酸溶于水,与苯分层,则除杂试剂为溶液,分离方法为分液,故答案为:酸性高锰酸钾溶液;分液.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度不大.

练习册系列答案
相关题目
9.下列有关化学用语使用正确的是( )
| A. | 乙烯的结构式为:CH2CH2 | |
| B. | NH4C1的电子式: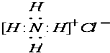 | |
| C. | Cr原子 的基态简化电子排布式为[Ar]3d54s1 | |
| D. | S原子的价电子轨道表示式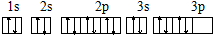 |
10.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,有良好的超导性.下列关于K3C60的组成和结构分析正确的是( )
| A. | K3C60中既有离子键,又有共价键 | |
| B. | 1molK3C60中含有的离子数目为63×6.02×1023 | |
| C. | 通常条件下该晶体有良好的导电性 | |
| D. | 该物质的化学式可写为KC20 |
7.短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36.且原子最外层电子数之和为14;A与C,B与D分别为同主族;含有C元素的物质灼烧时火焰呈黄色.下列叙述正确的是( )
| A. | A与B只能形成一种化合物 | |
| B. | B的离子半径小于C的离子半径 | |
| C. | D元素最高价氧化物的水化物显两性 | |
| D. | 由A、B、C形成的化合物既含离子键又含共价键 |
14.科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2$?_{释氢}^{储氢}$HCOONa+H2O.下列有关说法正确的是( )
| A. | 储氢、释氢过程均无能量变化 | |
| B. | NaHCO3只含离子键 | |
| C. | 储氢过程中,NaHCO3被还原 | |
| D. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
4.短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:①R、Y原子的最外层电子数与电子层数相同;②Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③W与R同主族.下列说法正确的是( )
| A. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,与水反应产物不完全相同 | |
| B. | 元素T、Q、W、Y的原子半径大小为:T<Q<Y<W | |
| C. | Q与Y组成的常见物质是一种两性物质,结构中含有离子键 | |
| D. | 由Y和T组成的物质YT是,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
9.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | NaH2PO4水溶液呈酸性,其溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(PH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| D. | O.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
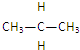 和
和 互为同位素的是②,互为同素异形体的是①,互为同系物的是④,互为同分异构体的是③,其名称分别为正丁烷、异丁烷,互为同一物质的是⑤.
互为同位素的是②,互为同素异形体的是①,互为同系物的是④,互为同分异构体的是③,其名称分别为正丁烷、异丁烷,互为同一物质的是⑤.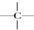 ,一个-CH2-和一个-Cl,它可能的结构简式是CH3C(CH3)2CH2Cl.(任意写出一种)
,一个-CH2-和一个-Cl,它可能的结构简式是CH3C(CH3)2CH2Cl.(任意写出一种)