��Ŀ����
6��һ�������£�������㶨���ܱ������м���1mol N2��3mol H2������Ӧ��N2��g��+3H2��g��$?_{����}^{���¸�ѹ}$2NH3��g����H��0�������й�˵����ȷ���ǣ�������| A�� | �����¶ȿ��Լӿ췴Ӧ���� | |
| B�� | �ﵽ��ѧ��Ӧ��ʱ������2mol NH3 | |
| C�� | 1mol N2 ��3mol H2������������2mol NH3�������� | |
| D�� | ���������ټ���N2�ɼӿ�����Ӧ���� |
���� A�����»�ѧ��Ӧ���ʼ�����
B�����淴Ӧ�ķ�Ӧ�ﲻ����ȫת����
C����Ӧ���ȣ�˵����Ӧ���������������
D������Ũ�ȣ���Ӧ���ʼӿ죮
��� �⣺A�����»�ѧ��Ӧ���ʼ�������A����
B���ϳɰ��ǿ��淴Ӧ�����淴Ӧ�ķ�Ӧ�ﲻ����ȫת��Ϊ���������1mol N2��3mol H2������Ӧ���ɵİ�������2mol����B����
C����Ӧ���ȣ�˵��1mol N2��3mol H2������������2mol NH3������������C����
D������Ũ�ȣ���Ӧ���ʼӿ죬�����һ�����ܱ��������ټ��� N2��Ӧ���ʼӿ죬��D��ȷ��
��ѡD��
���� ���⿼����Ӱ�컯ѧ��Ӧ���ʵ����ء����淴Ӧ���ص㡢��Ӧ�ʱ��뷴Ӧ��������������ϵ����Ŀ�ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
16��Ϊ��֤��ij�����к��������ӣ�ѡ�ø������Լ��Ͳ����������˳����ȷ���ǣ�������
�ٵμ�AgNO3��Һ �ڼ�ˮ�ܽ� �ݹ��ˡ�ȡ��Һ ����������̻�ϼ��� �ݼ�ϡHNO3 ����Ũ���ᷴӦ ��NaOH��Һ���� ���õ��۵⻯�أ�
�ٵμ�AgNO3��Һ �ڼ�ˮ�ܽ� �ݹ��ˡ�ȡ��Һ ����������̻�ϼ��� �ݼ�ϡHNO3 ����Ũ���ᷴӦ ��NaOH��Һ���� ���õ��۵⻯�أ�
| A�� | �ܢڢۢ٢� | B�� | �ޢ� | C�� | �ڢ٢� | D�� | �ޢߢ٢� |
1��X��Y�������ַǽ���Ԫ�أ�������˵���ǽ�����X��Yǿ���ǣ�������
| A�� | ��ԭ��X-ǿ��Y2- | |
| B�� | X�ĺ���������Ա�Y�ĺ����������ǿ | |
| C�� | X�ĵ���X2�ܽ�Y��������Y2-�������������û���Ӧ | |
| D�� | X���⻯���Y���⻯��е�� |
11��N2H4��һ����Ҫ�Ļ��ȼ�ϣ����ڿ�����ȼ�����ɵ�����ˮ���ų��������ȣ�����ʱ����֪�����ۼ��ļ������±���ͨ������N2H4��ȼ�����ǣ�������
| �� | N-H | N-N | O=O | N��N | H-O |
| ����/kJ•mol-1 | 391 | 193 | 497 | 946 | 463 |
| A�� | 1088 kJ•mol-1 | B�� | 544 kJ•mol-1 | C�� | 790 kJ•mol-1 | D�� | 382 kJ•mol-1 |
18�����������е����Ӽ���ǿ���ǣ�������
| A�� | KCl | B�� | CaCl2 | C�� | MgO | D�� | Na2O |
15�����б�ʾ���ʽṹ�Ļ�ѧ�����ģ��ͼ��ȷ���ǣ�������
| A�� | ������̼�ĵ���ʽ��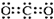 | B�� | 14C��ԭ�ӽṹʾ��ͼ�� | ||
| C�� | C3H8�ĽṹʽCH3-CH2-CH3 | D�� | ������ĵ���ʽ��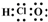 |
1��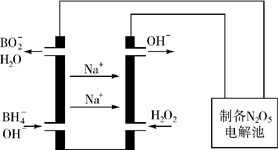 ������Ҫ�������簱���£�N2H4����NO��NO2��HNO3�������εȣ��������������о�����Ҫ���ã�
������Ҫ�������簱���£�N2H4����NO��NO2��HNO3�������εȣ��������������о�����Ҫ���ã�
��1������NH3�Ļ�ԭ�Կ����������������Ⱦ������Ȼ�ѧ����ʽ���£�
H2O��l��=H2O��g����H1=+44.0kJ•mol-1
N2��g��+O2��g��=2NO��g����H2=+229.3kJ•mol-1
4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H3=-906.5kJ•mol-1
4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H4�����H4=-2317.0kJ•mol-1��
��2����������һ�����ᣬ��֤����������������ʵ���AD
A�������£�����������Һ��pH��7
B���������ܺ�NaOH�����кͷ�Ӧ
C�������� �� ��Һ��������ʵ�飬���ݺܰ�
D�������£���pH=3����������Һϡ��10����pH��4
��3��һ���¶��£���a mol/L�İ�ˮ��b mol/LH2SO4��Һ�������ϣ���ַ�Ӧ���У�2c��SO42-��=c��NH4+�����ú�a��b�Ĵ���ʽ��ʾ�û����Һ��NH3•H2O�ĵ��볣��Ϊ$\frac{2b}{a-2b}$��10-7��
��4��ʹ��NaBH4Ϊ�յ�������ʹCo2+�����ڼ��������·�����Ӧ���Ƶøߴ��������ܣ��ù��̲������ж����壬д���÷�Ӧ�����ӷ���ʽ��2Co2++N2H4+4OH-=2Co��+N2��+4H2O��
��5��X��Y��Z��W�ֱ���HNO3��NH4NO3��NaOH��NaNO2����ǿ������е�һ�֣��±��dz�����Ũ�Ⱦ�Ϊ0.01mol•L-1��X��Y��Z��W��Һ��pH��
��X��Y��Z��1molͬʱ����ˮ���Ƶû����Һ��������Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊc��Na+����c��NO3-����c��NO2-����c��OH-����c��H+����
 ������Ҫ�������簱���£�N2H4����NO��NO2��HNO3�������εȣ��������������о�����Ҫ���ã�
������Ҫ�������簱���£�N2H4����NO��NO2��HNO3�������εȣ��������������о�����Ҫ���ã���1������NH3�Ļ�ԭ�Կ����������������Ⱦ������Ȼ�ѧ����ʽ���£�
H2O��l��=H2O��g����H1=+44.0kJ•mol-1
N2��g��+O2��g��=2NO��g����H2=+229.3kJ•mol-1
4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H3=-906.5kJ•mol-1
4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H4�����H4=-2317.0kJ•mol-1��
��2����������һ�����ᣬ��֤����������������ʵ���AD
A�������£�����������Һ��pH��7
B���������ܺ�NaOH�����кͷ�Ӧ
C�������� �� ��Һ��������ʵ�飬���ݺܰ�
D�������£���pH=3����������Һϡ��10����pH��4
��3��һ���¶��£���a mol/L�İ�ˮ��b mol/LH2SO4��Һ�������ϣ���ַ�Ӧ���У�2c��SO42-��=c��NH4+�����ú�a��b�Ĵ���ʽ��ʾ�û����Һ��NH3•H2O�ĵ��볣��Ϊ$\frac{2b}{a-2b}$��10-7��
��4��ʹ��NaBH4Ϊ�յ�������ʹCo2+�����ڼ��������·�����Ӧ���Ƶøߴ��������ܣ��ù��̲������ж����壬д���÷�Ӧ�����ӷ���ʽ��2Co2++N2H4+4OH-=2Co��+N2��+4H2O��
��5��X��Y��Z��W�ֱ���HNO3��NH4NO3��NaOH��NaNO2����ǿ������е�һ�֣��±��dz�����Ũ�Ⱦ�Ϊ0.01mol•L-1��X��Y��Z��W��Һ��pH��
| 0.01mol•L-1����Һ | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
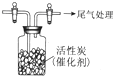 ijѧϰС���Ʋ�SO2����ǿ������Cl2��Ӧ����SO2Cl2��Ϊ�˽���̽����
ijѧϰС���Ʋ�SO2����ǿ������Cl2��Ӧ����SO2Cl2��Ϊ�˽���̽����