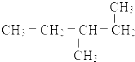题目内容
8.生成1mol下列化学键,放出热量最多的是( )| A. | H-I | B. | H-Br | C. | H-Cl | D. | H-F |
分析 卤素单质活泼性依次减弱,能量降低,和氢气化合形成氢化物放出的热量依次减少,据此分析判断
解答 解:同主族自上而下卤素单质活泼性依次减弱,能量降低,F2>Cl2>Br2>I2,与氢气化合生成氢化物稳定性减弱,所以生成1mol下列化学键H-F,放出热量最多,
故选D.
点评 本题考查了化学键的形成过程分析判断,主要是同主族单质稳定性与能量的关系分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
16.为了证明某固体中含有氯离子,选用给出的试剂和操作,其操作顺序正确的是( )
①滴加AgNO3溶液 ②加水溶解 ⑤过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀HNO3 ⑥与浓盐酸反应 ⑦加NaOH溶液加热 ⑧用淀粉碘化钾.
①滴加AgNO3溶液 ②加水溶解 ⑤过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀HNO3 ⑥与浓盐酸反应 ⑦加NaOH溶液加热 ⑧用淀粉碘化钾.
| A. | ④②③①⑤ | B. | ⑥⑧ | C. | ②①⑤ | D. | ⑥⑦①⑤ |
3.室温下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | pH=10的Na2CO3溶液:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+$\frac{1}{2}$c(C2O42-) | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |
13.短周期元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | X的最高价氧化物对应的水化物的酸性比W的弱 | |
| C. | Y的气态简单氢化物的热稳定性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型相同 |
18.下列物质中的离子键最强的是( )
| A. | KCl | B. | CaCl2 | C. | MgO | D. | Na2O |
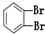 ⑨235U ⑩
⑨235U ⑩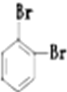
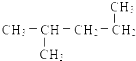 ⑫
⑫