题目内容
9. 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.实验目的:探究Cu和Ag的金属活动性顺序
(1)电极材料:正极:银片;负极:铜片;硝酸银溶液的作用是参与氧化还原反应和导电.
(2)写出电极反应式:正极:Ag++e-=Ag;负极:Cu-2e-=Cu2+.
(3)实验现象:负极不断溶解,正极上有白色的银单质析出,溶液从无色变为蓝色.
(4)实验结论:金属的活泼性是Cu>Ag.
分析 利用置换反应Cu+2AgNO3=Cu(NO3)2+2Ag,说明Cu和Ag的金属活动性顺序,据此设计原电池时,Cu为负极,Ag为正极,工作时,正极反应式为Ag++e-=Ag,有金属析出,负极反应式为Cu-2e-=Cu2+,Cu逐渐溶解,根据原电池的工作原理来回答即可.
解答 解:(1)原电池时,Cu为负极,Ag为正极,电解质是硝酸银溶液,故答案为:银片;铜片;参与氧化还原反应和导电;
(2)原电池的正极上是电解质中的阳离子得电子的还原反应,即Ag++e-=Ag,负极上是电极本身发生失电子的氧化反应,即Cu-2e-=Cu2+,
故答案为:Ag++e-=Ag;Cu-2e-=Cu2+;
(3)负极上是电极本身发生失电子的氧化反应,电极不断溶解,正极上是电解质中的阳离子银离子得电子的还原反应,有白色的银单质析出,溶液从无色变为蓝色,故答案为:负极不断溶解,正极上有白色的银单质析出,溶液从无色变为蓝色;
(4)根据原电池反应的现象,得出金属Cu可以将金属银从其盐中置换出来,所以金属的活泼性是Cu>Ag,故答案为:金属的活泼性是Cu>Ag;
点评 本题考查学生原电池的工作原理、应用以及电极反应式的书写等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
4.下列变化过程,属于放热过程的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
| A. | ②③④⑥ | B. | ①②⑥ | C. | ②③④⑤ | D. | ①③⑤ |
1.X、Y代表两种非金属元素,下列能说明非金属性X比Y强的是( )
| A. | 还原性X-强于Y2- | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质X2能将Y的阴离子Y2-氧化,并发生置换反应 | |
| D. | X的氢化物比Y的氢化物沸点高 |
18.下列物质中的离子键最强的是( )
| A. | KCl | B. | CaCl2 | C. | MgO | D. | Na2O |
19. 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
据此可判断( )
 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
| A. | a<b | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 上述反应是放热反应 |




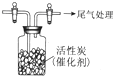 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.