题目内容
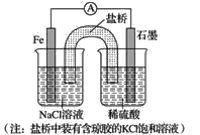
【题目】一氧化氮-空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电环保三位一体的结合。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和粗铜的精炼原理。
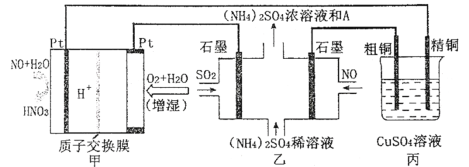
(1)燃料电池放电过程中负极的电极反应式____。
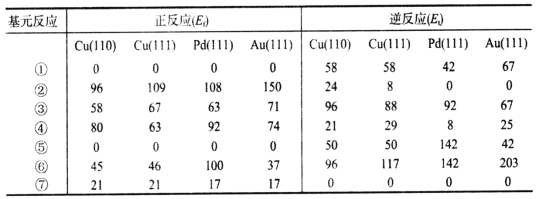
(2)乙装置中物质A是____(填化学式),理由是___;电解过程中阳极附近pH___(填“增大”“减小”或“不变”),阴极的电极反应式是____。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO4溶液的浓度将__(填“增大”、“减小”或“不变”)。
(4)若在标准状况下,甲装置有22.4 L O2参加反应,则乙装置中转化SO2和NO的物质的量共有____mol;丙装置中阴极析出铜的质量为___g。
【答案】NO-3e-+2H2O=![]() +4H+ H2SO4 根据反应5SO2+2NO+8H2O
+4H+ H2SO4 根据反应5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4,产物中除有(NH4)2SO4外还有H2SO4或阳极的电极反应为SO2-2e-+2H2O=
(NH4)2SO4+4H2SO4,产物中除有(NH4)2SO4外还有H2SO4或阳极的电极反应为SO2-2e-+2H2O=![]() +4H+,故A为H2SO4 减小 NO+5e-+6H+=
+4H+,故A为H2SO4 减小 NO+5e-+6H+=![]() +H2O 减小 2.8 128
+H2O 减小 2.8 128
【解析】
根据题中图示,判断原电池甲的正负极,写出燃料电池电极反应;根据题中图示,判断电解池乙的阴阳极,写出阴阳极电极反应,据此分析解答;根据粗铜精炼原理,判断Cu2+减少;根据转移电子守恒,计算相应的物质的量及质量。
(1)由题中图示可知,左端NO中N元素化合价由+2价失电子变成+5价,发生氧化反应,由原电池的工作原理图示可知,左端的铂电极为原电池负极,其电极反应:NO-3e-+2H2O=![]() +4H+;答案为NO-3e-+2H2O=
+4H+;答案为NO-3e-+2H2O=![]() +4H+。
+4H+。
(2)由题中图示可知,通SO2的石墨电极与电源正极相连,为阳极,失电子发生氧化反应,其电极反应为SO2-2e-+2H2O=![]() +4H+,通NO的石墨电极为阴极,得电子发生还原反应,其电极反应为NO+5e-+6H+=
+4H+,通NO的石墨电极为阴极,得电子发生还原反应,其电极反应为NO+5e-+6H+=![]() +H2O,总反应方程式为5SO2+2NO+8H2O
+H2O,总反应方程式为5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4,产物中除有(NH4)2SO4外还有H2SO4或阳极的电极反应为SO2-2e-+2H2O=
(NH4)2SO4+4H2SO4,产物中除有(NH4)2SO4外还有H2SO4或阳极的电极反应为SO2-2e-+2H2O=![]() +4H+,A为H2SO4,由阳极的电极反应为SO2-2e-+2H2O=
+4H+,A为H2SO4,由阳极的电极反应为SO2-2e-+2H2O=![]() +4H+,可知电解过程中阳极附近pH减小,阴极的电极反应式是NO+5e-+6H+=
+4H+,可知电解过程中阳极附近pH减小,阴极的电极反应式是NO+5e-+6H+=![]() +H2O;答案为H2SO4,由总反应方程式为5SO2+2NO+8H2O
+H2O;答案为H2SO4,由总反应方程式为5SO2+2NO+8H2O![]() (NH4)2SO4+4H2SO4可知,产物中除有(NH4)2SO4外还有H2SO4或阳极的电极反应为SO2-2e-+2H2O=
(NH4)2SO4+4H2SO4可知,产物中除有(NH4)2SO4外还有H2SO4或阳极的电极反应为SO2-2e-+2H2O=![]() +4H+,A为H2SO4,减小,NO+5e-+6H+=
+4H+,A为H2SO4,减小,NO+5e-+6H+=![]() +H2O。
+H2O。
(3)丙装置中,粗铜作阳极,粗铜中含有锌、银等杂质,阳极上金属失电子发生氧化反应,阴极上铜离子得电子生成铜,根据转移电子守恒,阳极上Zn比Cu活泼,Zn会失电子变成Zn2+,阳极上铜消耗的质量小于阴极上析出铜的质量,所以溶液中硫酸铜浓度减小;答案为减小。
(4)在标准状况下,甲装置有22.4 L O2参加反应,即1molO2参加反应,转移4mol电子,由转移电子守恒得,阳极SO2-2e-+2H2O=![]() +4H+,转移4mol电子,参加反应SO2为2mol,阴极NO+5e-+6H+=NH4++H2O,转移4mol电子,参加反应NO为0.8mol,乙装置中转化SO2和NO的物质的量共有2mol+0.8mol=2.8mol,丙装置中阴极电极反应为Cu2++2e-=Cu,转移4mol电子,析出2molCu,析出铜的质量为2mol×64g/mol=128g;答案为2.8,128。
+4H+,转移4mol电子,参加反应SO2为2mol,阴极NO+5e-+6H+=NH4++H2O,转移4mol电子,参加反应NO为0.8mol,乙装置中转化SO2和NO的物质的量共有2mol+0.8mol=2.8mol,丙装置中阴极电极反应为Cu2++2e-=Cu,转移4mol电子,析出2molCu,析出铜的质量为2mol×64g/mol=128g;答案为2.8,128。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案