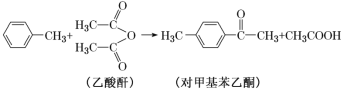
题目内容
【题目】铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
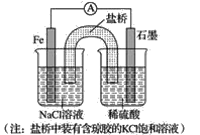
(1)①某原电池装置如图所示,右侧烧杯中的电极反应式为__,左侧烧杯中的c(Cl-)__(填“增大”、“减小”或“不变”)。
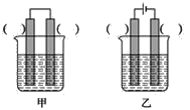
②已知如图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料_____(填“Fe”或“C”)。
(2)装置丙中,易生锈的是__(填“a”或“b”)点。装置丁中可观察到的实验现象是__。

【答案】2H++2e-=H2↑ 增大 甲池中:左—Fe,右—C;乙池中:左—Fe,右—C a 铁屑表面生成红棕色锈斑,试管内液面上升
【解析】
(1)①图为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生2H++2e-=H2;原电池中阴离子向负极移动;
②Fe和H2SO4之间的反应结合电解池和原电池的原理分析回答;
(2)装置丙中,根据易生锈的是构成原电池作负极的分析,根据吸氧腐蚀消耗了空气中的氧气,使试管内压强降低,则大气压使试管中液面会上升.
(1)①电池反应中Fe作负极,石墨棒作正极,右侧电极反应式为2H++2e-=H2↑。由于平衡电荷的需要,盐桥中的Cl-向负极迁移,故NaCl溶液中c(Cl-)增大。
故答案为:2H++2e-=H2↑;增大;
②装置乙是电解装置,阴极(右侧)产生H2,同时根据总反应式可知Fe只能作阳极(左侧)。由已知条件知,在装置甲中,Fe作原电池的负极,在左侧,C作原电池的正极,在右侧。
故答案为:甲池中:左—Fe,右—C;乙池中:左—Fe,右—C
(2)装置丙中由于a点既与电解液接触,又与空气接触,故易生锈。装置丁中铁屑发生吸氧腐蚀,负极:Fe-2e-=Fe2+,正极:O2+4e-+2H2O=4OH-,生成的离子继续反应:Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,2Fe(OH)3=Fe2O3·xH2O+(3-x)H2O,由整个反应来看,最终铁屑表面会生成红棕色的铁锈,由于反应消耗氧气,因此试管内液面上升。
故答案为:a;生铁表面生成红棕色锈斑,试管内液面上升.

【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
Ⅰ.(1)氮的固定是几百年来科学家一直研究的课题。
下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2(g)+O2(g) | 工业固氮 N2(g)+3H2(g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于_____(填“吸热”或“放热”)反应。
②分析数据可知;人类不适合大规模模拟大气固氮的原因_____。
(2)NaNO2是一种食品添加剂(有毒性,市场上常误与食盐混淆)。可用酸性KMnO4溶液检验,完成其反应的离子方程式。MnO![]() +NO
+NO![]() +_____=Mn2++NO
+_____=Mn2++NO![]() +H2O。
+H2O。
(3)工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)
CO(NH2)2(l)+H2O(l) △H<0。T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() = x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
= x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。
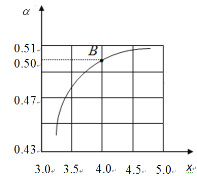
其它条件不变时,α随着x/span>增大而增大的原因是____;图中的B点处NH3的平衡转化率为____。
II.(4)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g)=2PCl3(g) △H1=-612 kJ· mol-1
2P(s) + 5Cl2(g)=2PCl5(g) △H2=-798 kJ· mol-1
气态PCl5生成气态PCl3和Cl2的热化学方程式为________。
(5)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=___(用n表示)。
(6)一定温度下,向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成__沉淀(填化学式);当测得溶液中钙离子沉淀完全(浓度小于10-5 mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c = ______mol·L-1。(已知:Ksp[Mg3(PO4)2] =6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。)