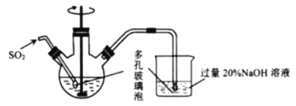
题目内容
【题目】关于水煤气变换反应CO(g)+H2O![]() CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
①H2O+*![]() H2O* ②H2O*+*
H2O* ②H2O*+*![]() OH*+H* ③OH*+*
OH*+H* ③OH*+*![]() O*+H* ④2H*+*
O*+H* ④2H*+*![]() H2+2*
H2+2*
⑤CO+*![]() CO* ⑥CO*+O*
CO* ⑥CO*+O*![]() CO2*+* ⑦CO2*
CO2*+* ⑦CO2*![]() CO2+*
CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是___________(填序号)。
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=____kJ·mol-1。
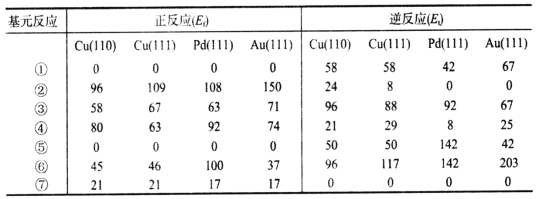
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图像。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是_______________。
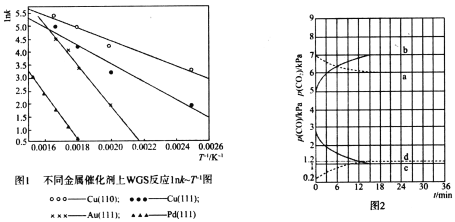
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是_________、_________;T2、T3时WGS反应的KP分别为______、_______。
【答案】② -44 Cu(110) d a 25 49
【解析】
总反应为基元反应的综合,根据盖斯定律计算反应热,反应速率的决定步骤为慢反应步骤,通过反应的焓变判断不同温度下平衡常数的大小,并以此判断曲线。
(1)分析表中数据,反应所需的活化能越高,反应越难发生,故该机理中WGS反应的速率控制步骤是②。
(2)由表中数据可知,正反应的活化能是7个正向基元反应的活化能的和,逆反应的活化能是7个逆向基元反应的活化能的和,Cu(111)催化WGS反应的焓变△H=E正-E逆=(109+67+63+46+21)kJ·mol-1-(58-8-88-29-50-117)kJ·mol-1=-44kJ·mol-1。
(3)图1是反应速率常数的自然对数与温度倒数的关系图像。由图1可判断550K~600K温度范围内,Cu(110)的反应速率常数值最高,四种催化剂中活性最好的是Cu(110)。
(4)温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),反应为放热反应,降低温度,反应正向移动,平衡常数增大,实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。已知T1时WGS反应的KP=18>1,则平衡时p(CO2)> p(CO)。计算对应温度下的平衡常数,若平衡时两气体为图中实线,则K=![]() ,若平衡时两气体为图中虚线,则K=
,若平衡时两气体为图中虚线,则K=![]() 。T2>T3,则T2平衡常数应比T3小,故T2时,表示p(CO)、p(CO2)的曲线分别是d、a; T2、T3时WGS反应的KP分别为25、49。
。T2>T3,则T2平衡常数应比T3小,故T2时,表示p(CO)、p(CO2)的曲线分别是d、a; T2、T3时WGS反应的KP分别为25、49。

【题目】下列各组物质中,能一步实现下图所示①~⑤转化关系的是

X | Y | Z | W | |
A | C | CO | CO2 | Na2CO3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D