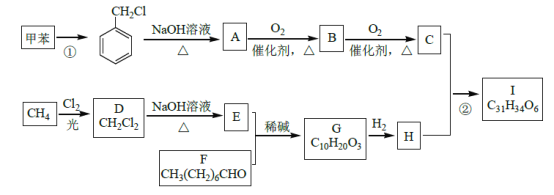
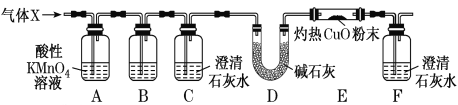
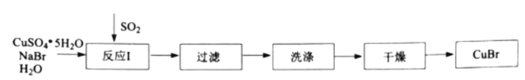
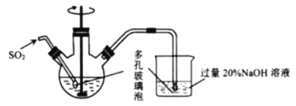
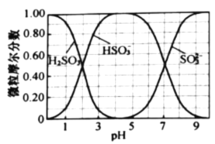
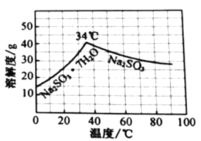
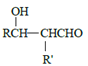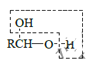题目内容
【题目】在一真空容器中充入2molSO2和1molO2,发生反应2SO2(g)+O2(g)![]() 2SO3(g),在一定条件下达到平衡时,SO2的转化率为85%。若在同一容器中,在相同温度下向容器中充入SO3,欲使达到平衡时,各成分的体积分数与上述平衡相同,则起始时SO3的物质的量和达到平衡时SO3的转化率为( )
2SO3(g),在一定条件下达到平衡时,SO2的转化率为85%。若在同一容器中,在相同温度下向容器中充入SO3,欲使达到平衡时,各成分的体积分数与上述平衡相同,则起始时SO3的物质的量和达到平衡时SO3的转化率为( )
A.2mol85%B.1mol42.5%C.2mol15%D.1mol30%
【答案】C
【解析】
在相同的温度下,使平衡时各成分的百分含量相同,说明两平衡是等效平衡;按化学计量转化到一边,对应成分的物质的量相同,根据方程式2SO2(g)+O2(g)![]() 2SO3(g)可知,2molSO2和1molO2完全转化,可得n(SO3)=n(SO2)=2mol,故从SO3开始进行反应,达相同的平衡状态,需要SO3的物质的量为2mol;;从SO2和O2起始达平衡时,SO2的转化率为85%,SO2转化的n(SO2)=2mol×85%=1.7mol,由硫元素守恒可知据平衡时n(SO3)=n(SO2)=1.7mol,所以从SO3开始进行反应,达相同的平衡状态,SO3的物质的量相同为1.7mol,转化的SO3的物质的量为2mol1.7mol=0.3mol,SO3转化率为
2SO3(g)可知,2molSO2和1molO2完全转化,可得n(SO3)=n(SO2)=2mol,故从SO3开始进行反应,达相同的平衡状态,需要SO3的物质的量为2mol;;从SO2和O2起始达平衡时,SO2的转化率为85%,SO2转化的n(SO2)=2mol×85%=1.7mol,由硫元素守恒可知据平衡时n(SO3)=n(SO2)=1.7mol,所以从SO3开始进行反应,达相同的平衡状态,SO3的物质的量相同为1.7mol,转化的SO3的物质的量为2mol1.7mol=0.3mol,SO3转化率为![]() ;
;
答案为C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目