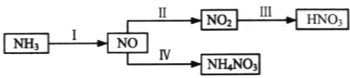
题目内容
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,
CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ 热量,写出该反应的热化学方程式:_________________________________
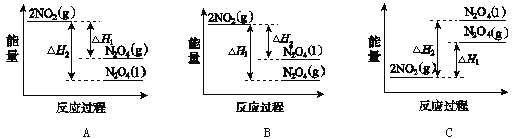
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
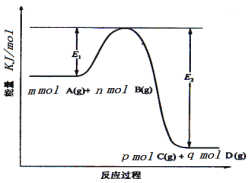
该反应△H =____kJ/mol(用含E1、E2式子表示); 在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:
CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K
H2 (g) +CO2 (g)平衡常数K
C(s) +CO2 (g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2
CO(g) +H2 (g)平衡常数K2
则K、K1 、K2之间的关系是 ___________________________________
【答案】< 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol △H=-(E2-E1)kJ/mol 减小 减小 K=![]()
【解析】
(1)1mol甲醇完全燃烧生成CO2(g)和H2O(l)时, 放出的热量比生成CO2(g)和H2O(g)时,放出的热量多;
(2)有1 mol Cl2参与反应时释放出145 kJ 热量,2mol Cl2参与反应时释放出290 kJ 热量,据此写出反应的热化学方程式;
(3)H=反应物的总键能-生成物的总键能,所以H=E1-E2;加入催化剂改变了反应的途径,降低了反应所需的活化能;
(4)分别写出平衡常数K1、K2、K的表达式,据此可找出K与K2、K1之间的关系。
(1)燃烧热是1mol物质完全燃烧生成稳定的氧化物时放出的热量,1mol甲醇完全燃烧生成CO2(g)和H2O(l)时, 放出的热量为238.6 kJ,而当1mol甲醇完全燃烧生成CO2(g)和H2O(g)时,放出的热量小于238.6 kJ,故a<238.6;
故答案是:<;
(2)有1 mol Cl2参与反应时释放出145 kJ 热量,2mol Cl2参与反应时释放出290 kJ 热量,反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol;
故答案是:2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol;
(3)由图像可知该反应是一个能量降低的反应,所以属于放热反应;H=反应物的总键能-生成物的总键能,所以H=(E1-E2)kJ/mol;加入催化剂改变了反应的途径,降低了反应所需的活化能,所以E1、E2的变化是减小;
故答案是:△H= -(E2-E1)kJ/mol; 减小;减小;
(4)C(s) +CO2 (g)![]() 2CO(g)反应的平衡常数K1=c2(CO)/c(CO2);C (s) +H2O (g)
2CO(g)反应的平衡常数K1=c2(CO)/c(CO2);C (s) +H2O (g)![]() CO(g) +H2 (g)反应的平衡常数K2 = c(CO)c(H2)/c(H2O);CO (g) +H2O (g)
CO(g) +H2 (g)反应的平衡常数K2 = c(CO)c(H2)/c(H2O);CO (g) +H2O (g)![]() H2 (g) +CO2 (g)反应的平衡常数K= c(CO2)×c(H2)/ c(CO)×c(H2O),所以K=K2/K1;
H2 (g) +CO2 (g)反应的平衡常数K= c(CO2)×c(H2)/ c(CO)×c(H2O),所以K=K2/K1;
故答案是:K=K2/K1。

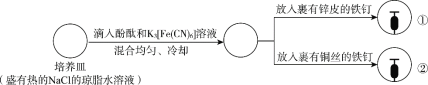
【题目】下列根据实验操作及现象进行的分析和推断中,不正确的是
操作 |
|
现象 | 一段时间后:①中,铁钉裸露在外的附近区域变红; ②中…… |
A.NaCl的琼脂水溶液为离子迁移的通路
B.①中变红是因为发生反应2H++2e-=H2↑,促进了水的电离
C.②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红
D.①和②中发生的氧化反应均可表示为M—2e-=M2+(M代表锌或铁)