题目内容
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )
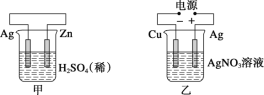
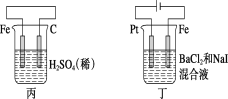
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
【答案】C
【解析】
由图可知:甲图为原电池,其中Zn为负极,失去电子,生成Zn2+;乙图为电解池,银与电源的正极相连接,为阳极,发生氧化反应;丙图为原电池,铁作负极,失去电子发生氧化反应,电解液中的H+得到电子,发生还原反应;丁图为电解池,铁与电源的负极相连,为阴极,Pt与电源的正极相连,为阳极,阳极上I-先失去电子发生氧化反应。
A. 甲图中Zn为负极,失去电子,生成Zn2+,电极反应式为:Zn-2e-= Zn2+,A项错误;
B. 乙图中银与电源的正极相连接,为阳极,发生氧化反应。乙中阳极反应式为Ag-e-=Ag+,B项错误;
C. 丙中铁作负极,失去电子发生氧化反应,电解液中的H+得到电子向正极移动,即H+向碳棒方向移动,C项正确;
D. 丁图中Pt与电源的正极相连,为阳极,阳极上I-先失去电子发生氧化反应,D项错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】某小组通过分析镁与酸反应时pH的变化,探究镁与醋酸溶液反应的实质。
(实验)在常温水浴条件下,进行实验Ⅰ~Ⅲ,记录生成气体体积和溶液pH的变化:
Ⅰ.取0.1 g光亮的镁屑(过量)放入10 mL 0.10 mol·L–1 HCl溶液中;
Ⅱ.取0.1 g光亮的镁屑放入10 mL 0.10 mol·L–1 CH3COOH溶液(pH = 2.9)中;
Ⅲ.取0.1 g光亮的镁屑放入10 mL pH = 2.9 HCl溶液中。
(数据)
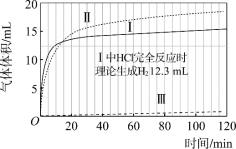
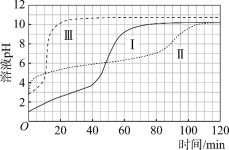
图1 图2
(1)起始阶段,Ⅰ中主要反应的离子方程式是____。
(2)Ⅱ起始溶液中![]() 约为____。(选填“1”、“10”或“102”)
约为____。(选填“1”、“10”或“102”)
(3)起始阶段,导致Ⅱ、Ⅲ气体产生速率差异的主要因素不是c(H+),实验证据是____。
(4)探究Ⅱ的反应速率大于Ⅲ的原因。
提出假设:CH3COOH能直接与Mg反应。
进行实验Ⅳ:____。
得出结论:该假设成立。
(5)探究醋酸溶液中与Mg反应的主要微粒,进行实验Ⅴ。
与Ⅱ相同的条件和试剂用量,将溶液换成含0.10 mol·L–1的 CH3COOH与0.10 mol·L–1 CH3COONa的混合溶液(pH = 4.8),气体产生速率与Ⅱ对比如下。
a.实验Ⅴ起始速率 | b.实验Ⅱ起始速率 | c.实验ⅡpH=4.8时速率 |
2.1 mL·min–1 | 2.3 mL·min–1 | 0.8 mL·min–1 |
对比a~c中的微粒浓度,解释其a与b、a与c气体产生速率差异的原因:____。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,CH3COOH、H+、H2O均能与镁反应产生氢气;
②____。
(7)实验反思:120 min附近,Ⅰ~ⅢpH均基本不变,pH(Ⅰ) ≈ pH(Ⅱ) < pH(Ⅲ),解释其原因:____。
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)