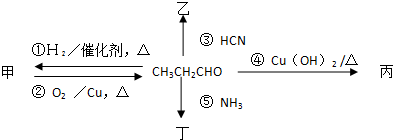
题目内容
19.下列有关化学用语的表述正确的是( )| A. | CCl4的电子式 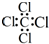 | B. | 苯的分子比例模型  | ||
| C. | 乙烯的结构式 CH2=CH2 | D. | 纤维素的分子式 C6H10O5 |
分析 A、四氯化碳中碳原子和氯原子均满足8电子稳定结构;
B、比例模型中可体现原子的相对大小,C原子比H原子大;
C、结构式中单键、双键不能省略;
D、纤维素为多糖,属于高分子化合物.
解答 解;A、四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为: ,故A错误;
,故A错误;
B、比例模型中可提现原子的相对大小,C原子比H原子大,苯的分子比例模型为 ,故B正确;
,故B正确;
C、结构式中单键、双键不能省略,CH2=CH2为结构简式,故C错误;
D、纤维素为多糖,属于高分子化合物,其分子式为(C6H10O5)n,故D错误;
故选B.
点评 本题考查化学用语,涉及电子式、结构式、分子式、比例模型等,注意化学用语的区别及规范应用,注重基础知识的考查,选项A中结构式与结构简式为易错点,题目难度不大.

练习册系列答案
相关题目
9.根据元素周期律作出的有关推断正确的是( )
| A. | Na、Mg、Al的还原性依次增强 | |
| B. | HF、HCl、HBr的热稳定性依次增强 | |
| C. | H3PO4、H2SO4、HClO4的酸性依次增强 | |
| D. | LiOH、NaOH、KOH、CsOH的碱性依次减弱 |
10.下列说法正确的是( )
| A. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3的方法冶炼Al | |
| B. | 灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素 | |
| C. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液中,则放出氢气的体积(同温同压下)不相等 |
4.随着卤素原子半径的增大,下列递变规律正确的是( )
| A. | 单质氧化性逐渐增强 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 卤素离子的还原性逐渐增强 | D. | 气态氢化物稳定性逐渐增强 |
8.下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
| A. | 2F2+2H2O═4HF+O2 | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl+MnO2═MnCl2+Cl2↑+2H2O |
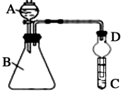
9.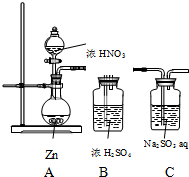 甲同学探究NO2的氧化性;设计了如下实验装置:
甲同学探究NO2的氧化性;设计了如下实验装置:
(1)该装置的明显缺陷是:无尾气处理装置
(2)实验开始后,发现Zn溶解,但未发现有气体逸出,同学猜想可能是因为HNO3被还原生成NH4+写出反应的离子方程式:4Zn+NO3-+10H+=4Zn2++NH4++3H2O 如何验证该猜想:取少量A中反应后的溶液置于试管中,向其中滴加少量氢氧化钠溶液,并加热,在试管口处放置一张湿润的红色石蕊试纸,若试纸变蓝,则猜想成立
(3)重新调整HNO3浓度后,发现A中有红棕色气体逸出,设计实验,证明NO2具有氧化性(药品意选择,合理即可)
(4)乙同学对甲的实验结果产生质疑,提出假设:
假一:NO2氧化了SO32-
假设二:HNO3氧化了SO32-
问题1:假设二是(“是”或“否”)合理,
理由:3NO2+H2O=2HNO3+NO(用化学方程式回答)
问题2:若要验证NO2具有氧化性,你的实验方案是:在一个真空密闭容器中同时通入NO2和SO2,一段时间后,容器中气体的红棕色褪去,证明了二者发生了反应,证明了NO2的氧化性.
 甲同学探究NO2的氧化性;设计了如下实验装置:
甲同学探究NO2的氧化性;设计了如下实验装置:(1)该装置的明显缺陷是:无尾气处理装置
(2)实验开始后,发现Zn溶解,但未发现有气体逸出,同学猜想可能是因为HNO3被还原生成NH4+写出反应的离子方程式:4Zn+NO3-+10H+=4Zn2++NH4++3H2O 如何验证该猜想:取少量A中反应后的溶液置于试管中,向其中滴加少量氢氧化钠溶液,并加热,在试管口处放置一张湿润的红色石蕊试纸,若试纸变蓝,则猜想成立
(3)重新调整HNO3浓度后,发现A中有红棕色气体逸出,设计实验,证明NO2具有氧化性(药品意选择,合理即可)
| 步骤 | 现象 | 结论 |
| 取少量C中反应后的溶液 置于试管中, 先加入盐酸溶液酸化,再加入 氯化钡溶液 | 有白色沉淀产生 | NO2具有氧化性 |
假一:NO2氧化了SO32-
假设二:HNO3氧化了SO32-
问题1:假设二是(“是”或“否”)合理,
理由:3NO2+H2O=2HNO3+NO(用化学方程式回答)
问题2:若要验证NO2具有氧化性,你的实验方案是:在一个真空密闭容器中同时通入NO2和SO2,一段时间后,容器中气体的红棕色褪去,证明了二者发生了反应,证明了NO2的氧化性.