题目内容
3.锶(Sr)为第5周期ⅡA族元素.高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水.用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如如图所示.
请回答下列问题:
(1)写出“溶浸”环节中碳酸锶发生反应的离子方程式SrCO3+2H+═Sr2++H2O+CO2↑
(2)“除杂”环节中,先加入适量A溶液和少量30%H2O2溶液,充分反应后,再调节溶液pH至8-10,过滤.
①A溶液的溶质是H2SO4(填化学式);
②加入少量30%H2O2溶液的目的是使Fe2+氧化到Fe3+.
③调节溶液pH至8-10,宜选用的试剂为BD(填序号).
A.氨水 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(3)步骤③需经过“洗涤,干燥”的操作,回答下列问题:
①洗涤氯化锶晶体最好选用氯化锶饱和溶液,其原因是既溶解晶体表面附着的杂质,又减少洗涤时氯化锶因溶解造成的损失.
②工业上用热风吹干六水氯化锶,选择的适宜温度范围是A(填字母).
A.50~60℃B.70~80℃C.80~100℃D.100℃以上
(4)工业上常以天青石(主要成分为硫酸锶,含不溶性杂质)为原料,采用以下方法制取碳酸锶:将天青石粉末与碳酸钠溶液的混合物在90℃时加热1~2h,经过滤、洗涤,得到碳酸锶.写出该反应的离子方程式(不必标明反应条件)SrSO4+CO32-=SrCO3+SO42-.
分析 (1)根据碳酸钙、碳酸钡与盐酸的反应可知,碳酸锶与盐酸反应生成氯化锶、水、二氧化碳.碳酸锶不溶于水,氯化锶易溶于水;
(2)①②加入少量30% H2O2溶液目的是除去亚铁离子,反应要在酸性溶液中进行;
③调节pH除去Fe3+等,不能引入杂质;
(3)①氯化锶晶体在氯化锶饱和溶液中的溶解度较小;
②由题中信息可知,当高于61℃时晶体会失去结晶水,故热风吹干六水氯化锶时温度应低于61℃;
(5)根据题中信息,硫酸锶能生成碳酸锶,说明碳酸锶的溶解度小于硫酸锶,根据元素守恒和电荷守恒书写反应的离子方程式.
解答 解:(1)碳酸锶与盐酸反应生成氯化锶、水、二氧化碳.碳酸锶不溶于水,氯化锶易溶于水.反应离子方程式为:SrCO3+2H+═Sr2++H2O+CO2↑,
故答案为:SrCO3+2H+═Sr2++H2O+CO2↑;
(2)加入少量30% H2O2溶液目的是除去亚铁离子,反应要在酸性条件下进行,所以
①A溶液的溶质是H2SO4,
故答案为:H2SO4;
②30% H2O2溶液能将Fe2+氧化到Fe3+,
故答案为:使Fe2+氧化到Fe3+;
③调节pH除去Fe3+等,要不能引入杂质,最好选用氢氧化锶粉末或氧化锶粉末;
故答案为:BD;
(3)①氯化锶晶体在氯化锶饱和溶液中的溶解度较小,洗涤氯化锶晶体选用氯化锶饱和溶液,既溶解晶体表面附着的杂质,又减少洗涤时氯化锶因溶解造成的损失,
故答案为:既溶解晶体表面附着的杂质,又减少洗涤时氯化锶因溶解造成的损失;
②由题中信息可知,当高于61℃时晶体会失去结晶水,故热风吹干六水氯化锶时温度应低于61℃,
故答案为:A;
(4)工天青石(主要成分为硫酸锶,含不溶性杂质)与碳酸钠溶液的混合物在90℃时加热1~2h,经过滤、洗涤,得到碳酸锶,根据元素守恒和电荷守恒可知该反应的离子方程式为SrSO4+CO32-=SrCO3+SO42-,
故答案为:SrSO4+CO32-=SrCO3+SO42-.
点评 本题以氯化锶的制备为载体,考查学生对工艺流程的理解、元素周期律、物质的分离提纯、沉淀转化等,综合性较强,涉及的知识点多,难度中等,需要学生具备阅读分析能力和灵活运用知识的解决问题能力.

| A. | A、E一定在不同周期 | |
| B. | D在第二周期 | |
| C. | A、D可能在同一主族 | |
| D. | C、D的单质可能化合形成离子化合物 |
| A. | 汽油和水,四氯化碳和水 | B. | 汽油和水,苯和水 | ||
| C. | 食用油和水,醋酸和水 | D. | 葡萄糖和水,酒精和水 |
| A. | 量取10mL该溶液倒入试管中,试管中,试管中Na+的物质的量为0.08mol | |
| B. | 该溶液的物质的量浓度为0.8mol•L-1 | |
| C. | 该溶液中含有46.8g NaCl | |
| D. | 配置50mL该溶液需用23.4g NaCl |
 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,它极易与水反应.为在实验室合成S2Cl2,某化学研究性学习小组查阅有关资料,有如下两种反应原理:
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,它极易与水反应.为在实验室合成S2Cl2,某化学研究性学习小组查阅有关资料,有如下两种反应原理:①CS2+3Cl2$\stackrel{95-100℃}{→}$CCl4+S2Cl2;②2S+Cl2$\stackrel{50-60℃}{→}$S2Cl2.
几种物质的熔、沸点数据如下表所示:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
(2)B中盛放饱和氯化钠溶液,其作用是除去氯化氢;C中盛放试剂的名称是浓硫酸.
(3)D装置中水从冷凝管下端通入(选填“上”或“下”).反应结束后,从D装置锥形瓶内的混合物中分离出产品的操作为蒸馏(填名称).
(4)S2Cl2与水反应产生无色、有刺激性气味的气体,并有黄色沉淀生成,该反应的化学万程式为2S2Cl2+2H2O=S↓+SO2↑+4HCl.
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:H2S+Na2CO3═NaHS+NaHCO3.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ce(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol/L.
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ.mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ.mol-1
另外还可发生③④两反应:
③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H3
④C(s)+CO2(g)═2CO(g)△H4
下列叙述不正确的是( )
| A. | 升高温度,可使①②③④反应速率均加快 | |
| B. | △H3=-110.5kJ.mol-1,△H4=+172.5kJ.mol-1 | |
| C. | 反应①②③④均属于化合反应、氧化还原反应 | |
| D. | CO的燃烧热是566.0kJ.mol-1 |
| A. | 2,3一二甲基丁烷 | B. | 3-甲基-1-丁烯 | ||
| C. | 间二甲苯 | D. | 4,4-二甲基-1-戊炔 |
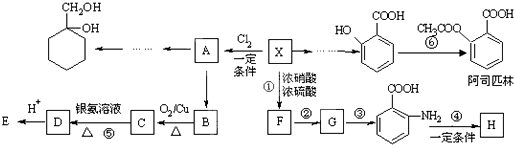
 Ⅱ
Ⅱ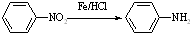 (苯胺,易被氧化)
(苯胺,易被氧化)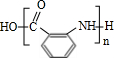 ;
; +2NaOH→
+2NaOH→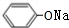 +HCOONa+H2O.
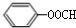
+HCOONa+H2O.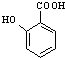 有多种同分异构体,其中含符合下列条件的共有2种.
有多种同分异构体,其中含符合下列条件的共有2种.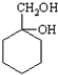 的过程.
的过程.