题目内容
9.在0.1L某浓度的NaCl溶液中含有0.8mol Na+,下列对该溶液的说法中,不正确的是( )| A. | 量取10mL该溶液倒入试管中,试管中,试管中Na+的物质的量为0.08mol | |
| B. | 该溶液的物质的量浓度为0.8mol•L-1 | |
| C. | 该溶液中含有46.8g NaCl | |
| D. | 配置50mL该溶液需用23.4g NaCl |
分析 A.溶液是均匀的,10mL溶液中Na+的物质的量为0.1L溶液中Na+的物质的量的$\frac{1}{10}$;
B.溶液中n(NaCl)=n(Na+),根据c=$\frac{n}{V}$计算判断;
C.根据m=nM计算溶液中NaCl的质量;
D.根据n=cV计算n(NaCl),再根据m=nM计算需要NaCl的质量.
解答 解:A.溶液是均匀的,10mL溶液中Na+的物质的量为0.8mol×$\frac{10mL}{100mL}$=0.08mol,故A正确;
B.溶液中n(NaCl)=n(Na+)=0.8mol,故NaCl的物质的量浓度=$\frac{0.8mol}{0.1L}$=8mol/L,故B错误;
C.溶液中n(NaCl)=n(Na+)=0.8mol,NaCl的质量=0.8mol×58.5g/mol=46.8g,故C正确;
D.50mL溶液中n(NaCl)=0.05L×8mol/L=0.4mol,故配制50 mL该溶液需用 NaCl的质量=0.4mol×58.5g/mol=23.4g,故D正确,
故选:B.
点评 本题考查学生对物质的量浓度理解,比较基础,故对公式的理解与灵活应用.

练习册系列答案
相关题目
19.下列物质在一定条件下可与CH4发生化学反应的是( )
| A. | 氢气 | B. | 溴水 | C. | 氧气 | D. | 酸性KMnO4溶液 |
20.标准状况下,1mol H2和1mol H2O相同的是( )
| A. | 质量 | B. | 体积 | C. | 原子数 | D. | 分子数 |
17.0.1mol某有机物完全燃烧后生成0.3mol C02,同质量的该有机物与足量的金属钠反应生成0.1mol H2,该有机物可能是 ( )
| A. | 丙三醇 | B. | 1,2-丙二醇 | C. | 1,3-丙二醇 | D. | 乙二醇 |
4.等质量的镁和铝分别跟足量盐酸反应,生成的氢气的分子数之比为( )
| A. | 1:1 | B. | 3:4 | C. | 3:2 | D. | 8:9 |
10.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:查询资料,得有关物质的数据如下表: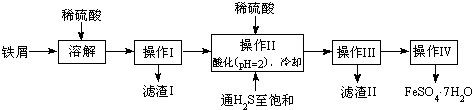
(1)检验制得的绿矾晶体中是否含有Fe3+,可以选用的试剂为AD.
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
④若定容时,视线高于液面,所测得的FeSO4•7H2O的质量分数偏高.(填“偏高”、“偏低”、“无影响”

| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀.
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时发生反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③计算上述样品中FeSO4•7H2O的质量分数为97.54%.
④若定容时,视线高于液面,所测得的FeSO4•7H2O的质量分数偏高.(填“偏高”、“偏低”、“无影响”
7.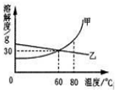 下表列出了固体物质A在不同温度时的溶解度:
下表列出了固体物质A在不同温度时的溶解度:
(1)70℃时,向盛有100g水的烧杯中加入30g固体A,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为3:10(填最简整数比);
(2)通过对上表数据的分析,物质A的溶解度曲线应是图中的乙(填“甲”或“乙”);
(3)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出?不确定(填“有”、“没有”或“不确定”).
 下表列出了固体物质A在不同温度时的溶解度:
下表列出了固体物质A在不同温度时的溶解度:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 36 | 35 | 34 | 33 | 32 | 31 | 30 | 29 | 28 | 27 |
(2)通过对上表数据的分析,物质A的溶解度曲线应是图中的乙(填“甲”或“乙”);
(3)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出?不确定(填“有”、“没有”或“不确定”).
