题目内容
4.已知A、B、C、D、E是核电荷数依次增大的五种周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )| A. | A、E一定在不同周期 | |
| B. | D在第二周期 | |
| C. | A、D可能在同一主族 | |
| D. | C、D的单质可能化合形成离子化合物 |
分析 B、E是同主族元素,表明B、E在不同周期,原子半径E>B,则B在E的上面周期中;
原子半径A<B,同时,原子序数A<B,表明AB不是在同一周期,因为周期中,原子序数越小,半径越大,因而A、B也不在同一周期中,则A应在第一周期,B、E分别在第二、第三周期;
原子半径D>E,核电荷数D<E,根据同周期原子半径的递变规律可知,D、E处于相同周期,则D应处于第三周期;
原子半径B>C,核电荷数B<C,根据同周期原子半径的递变规律可知,B、C在相同周期,以此解答该题.
解答 解:B、E是同主族元素,表明B、E在不同周期,原子半径E>B,则B在E的上面周期中;
原子半径A<B,同时,原子序数A<B,表明AB不是在同一周期,因为周期中,原子序数越小,半径越大,因而A、B也不在同一周期中,则A应在第一周期,B、E分别在第二、第三周期;
原子半径D>E,核电荷数D<E,根据同周期原子半径的递变规律可知,D、E处于相同周期,则D应处于第三周期;
原子半径B>C,核电荷数B<C,根据同周期原子半径的递变规律可知,B、C在相同周期,则
A.由上述分析可知,A在第一周期,B在第二周期,E在第三周期,故A正确;
B.由以上推断可知,A应在第一周期,B在第二周期,D在第三周期,故B错误;
C.若D为第三周期的Na,A为H,则A、D在同一主族,故C正确;
D.由于C为非金属,D为金属(可能),则C、D的单质有可能形成离子化合物,故D正确.
故选B.
点评 本题考查元素的位置结构性质的相关关系及应用,题目难度较大,本题侧重于原子序数与原子半径的大小关系为考查点,把握元素周期律的递变规律是解答该题的有力保证.

练习册系列答案
相关题目
14.某学习小组欲用如图装置制取纯净干燥的氯气,并探究其性质.
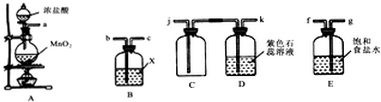
(1)装置A中发生反应的化学方程式为MnO2+4HCl(浓)═$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)欲制得干燥的氯气,B中广口瓶所装液体X为浓硫酸;
(3)欲收集纯净干燥的氯气并检验氯气部分性质,上述仪器接口的连接顺序为:
a→(g)→(f)→(b)→(c)→(j)→(k);
(4)连接好装置,将A中气体通入D中较长时间,可观察到的现象是石蕊试液先变红后褪色,最后呈浅黄绿色;
(5)实验设计及改进:利用制得的纯净干燥氯气,用下图装置证明Na2SO3具有还原性;同时对上述实验的不足进行改进.
试剂:Na2SO3溶液、Ba( NO3)2溶液、BaCl2溶液、稀盐酸、NaOH溶液、紫色石蕊溶液
试完成下列表格中的问题:

(1)装置A中发生反应的化学方程式为MnO2+4HCl(浓)═$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)欲制得干燥的氯气,B中广口瓶所装液体X为浓硫酸;
(3)欲收集纯净干燥的氯气并检验氯气部分性质,上述仪器接口的连接顺序为:
a→(g)→(f)→(b)→(c)→(j)→(k);
(4)连接好装置,将A中气体通入D中较长时间,可观察到的现象是石蕊试液先变红后褪色,最后呈浅黄绿色;
(5)实验设计及改进:利用制得的纯净干燥氯气,用下图装置证明Na2SO3具有还原性;同时对上述实验的不足进行改进.
试剂:Na2SO3溶液、Ba( NO3)2溶液、BaCl2溶液、稀盐酸、NaOH溶液、紫色石蕊溶液
试完成下列表格中的问题:
| 实验装置设计. | 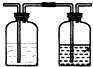 (注明所用试剂及气体流向) (注明所用试剂及气体流向)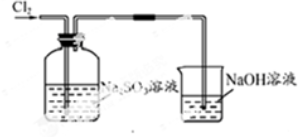 |
| 实验步驟及现象 | 连接好装置,将氯气通入亚硫酸钠溶液中,充分反应.取少量所得溶液与试管,滴入几滴氯化钡,有白色沉淀,再加入少量盐酸,沉淀不溶解. |
| 离子方程式 | Cl2+SO32-+H2O=2Cl-+SO42-+2H+; SO42-+Ba2+=BaSO4↓ |
| 结论 | Na2SO3具有还原性,能被氯气氧化成Na2SO4 |
15.下列过程中所发生的反应是取代反应的是( )
| A. | 光照甲烷和氯气的混合气体 | B. | 苯在镍催化作用下与氢气发生反应 | ||
| C. | 乙醇与酸性高锰酸钾溶液的反应 | D. | 苯和液溴混合加入铁粉的反应 |
19.下列物质在一定条件下可与CH4发生化学反应的是( )
| A. | 氢气 | B. | 溴水 | C. | 氧气 | D. | 酸性KMnO4溶液 |
9.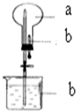 如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
 如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
如图所示:烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )| A. | a为HCl,b为H2O | B. | a为CO2,b为浓NaOH溶液 | ||
| C. | a为Cl2,b为饱和NaCl溶液 | D. | a为NH3,b为浓NH4Cl溶液 |
13.下列有关${\;}_{26}^{45}$Fe的说法中正确的是( )
| A. | 是一种新元素 | B. | 与${\;}_{26}^{56}$Fe互为同素异形体 | ||
| C. | 是一种新原子 | D. | 其中子数为26 |

 .
.