��Ŀ����
12����֪��25�桢101kPaʱ�ᷢ�����Т٢�����Ӧ����C��s��+O2��g���TCO2��g����H1=-393.5kJ��mol-1
��2CO��g��+O2��g���T2CO2��g����H2=-566.0kJ��mol-1
����ɷ����ۢ�����Ӧ��
��C��s��+$\frac{1}{2}$O2��g���TCO��g����H3
��C��s��+CO2��g���T2CO��g����H4
������������ȷ���ǣ�������
| A�� | �����¶ȣ���ʹ�٢ڢܷۢ�Ӧ���ʾ��ӿ� | |
| B�� | ��H3=-110.5kJ��mol-1����H4=+172.5kJ��mol-1 | |
| C�� | ��Ӧ�٢ڢܾۢ����ڻ��Ϸ�Ӧ��������ԭ��Ӧ | |
| D�� | CO��ȼ������566.0kJ��mol-1 |
���� A�������¶ȣ���Ӧ���ʶ�����
B�����ݸ�˹���ɢ�=��-�ڡ�$\frac{1}{2}$����=��-�ڽ��м��㣻
C�����ݶ�������һ��Ϊ���Ϸ�Ӧ���л��ϼ۱仯��Ϊ������ԭ��Ӧ�жϣ�
D��1mol��ȼ����ȫȼ�������ȶ�������ų�������Ϊȼ���ȣ�
��� �⣺A�������¶ȣ���Ӧ���ʶ��������������¶ȣ���ʹ�٢ڢܷۢ�Ӧ���ʾ��ӿ죬��A��ȷ��
B�����ݸ�˹���ɢ�=��-�ڡ�$\frac{1}{2}$����=��-�ڣ����H3=-393.5+566��$\frac{1}{2}$=-110.5kJ��mol-1����H4=-393.5+566=+172.5kJ��mol-1����B��ȷ��
C����Ϊ��������һ��Ϊ���Ϸ�Ӧ���л��ϼ۱仯��Ϊ������ԭ��Ӧ�����Է�Ӧ�٢ڢܾۢ����ڻ��Ϸ�Ӧ��������ԭ��Ӧ����C��ȷ��
D��1mol��ȼ����ȫȼ�������ȶ�������ų�������Ϊȼ���ȣ�2CO��g��+O2��g��=2CO2��g����H2=-566.0kJ•mol-1����CO��ȼ����Ϊ283.0 kJ•mol-1����D����
��ѡD��
���� ���⿼���˷�Ӧ�ȵļ��㡢��˹���ɵ�Ӧ�á�ȼ���ȵ��жϵȣ���Ŀ�ѶȲ���ע����ո�˹���ɵĺ��壮

��ϰ��ϵ�д�
�����Ŀ
13�������й�${\;}_{26}^{45}$Fe��˵������ȷ���ǣ�������
| A�� | ��һ����Ԫ�� | B�� | ��${\;}_{26}^{56}$Fe��Ϊͬ�������� | ||
| C�� | ��һ����ԭ�� | D�� | ��������Ϊ26 |
20����NA��������٤��������ֵ������˵����ȷ���ǣ�������
| A�� | 25��ʱ��pH=13��1.0L Ba��OH��2��Һ�к��е�Ba2+��ĿΪ0.05NA | |
| B�� | ��״���£�2.24L CH2Cl2ֻ���е�C-Cl������ĿΪ0.2NA | |
| C�� | 1.8g��ˮ��D2O��ֻ����NA������ | |
| D�� | ���³�ѹ�£�21g��ϩ�뻷����Ļ�����к���ԭ����ĿΪ3NA |
7��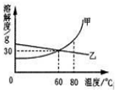 �±��г��˹�������A�ڲ�ͬ�¶�ʱ���ܽ�ȣ�
�±��г��˹�������A�ڲ�ͬ�¶�ʱ���ܽ�ȣ�
��1��70��ʱ����ʢ��100gˮ���ձ��м���30g����A���ٽ��ձ��������¶Ƚ���20�棬��ʱ��Һ���������ܼ���������Ϊ3��10������������ȣ���
��2��ͨ�����ϱ����ݵķ���������A���ܽ������Ӧ��ͼ�е��ң���ס����ҡ�����
��3��80��ʱ������һ���������ʵ���Һ�����併�µ�60�棬�Ƿ��й�����������ȷ������С�����û�С���ȷ��������
 �±��г��˹�������A�ڲ�ͬ�¶�ʱ���ܽ�ȣ�
�±��г��˹�������A�ڲ�ͬ�¶�ʱ���ܽ�ȣ�| �¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| �ܽ��/g | 36 | 35 | 34 | 33 | 32 | 31 | 30 | 29 | 28 | 27 |
��2��ͨ�����ϱ����ݵķ���������A���ܽ������Ӧ��ͼ�е��ң���ס����ҡ�����
��3��80��ʱ������һ���������ʵ���Һ�����併�µ�60�棬�Ƿ��й�����������ȷ������С�����û�С���ȷ��������
17���������ڷ���ʽ��ȷ���ǣ�������
| A�� | ��������Һ���������ˮ��Al3++3OH-�TAl��OH��3�� | |
| B�� | �������������Һ��ͨ��������Cl2+2OH-�TClO-+Cl-+H2O | |
| C�� | Cu����FeCl3��Һ��Fe3++Cu�TFe2++Cu2+ | |
| D�� | Zn������ϡ���ᷴӦ�����ر���ԭ����ͼۣ�4Zn+9H++NO${\;}_{3}^{-}$�T4Zn2++NH3��+3H2O |

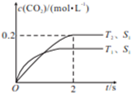 ����β������ɿ�����Ⱦ��ԭ��֮һ��������Ԫ�����еĴ�������ǿ����β���� CO��C��H����NO��������Ļ��ԣ�ʹ�������Ӧ��������Ⱦ�����ȥ��
����β������ɿ�����Ⱦ��ԭ��֮һ��������Ԫ�����еĴ�������ǿ����β���� CO��C��H����NO��������Ļ��ԣ�ʹ�������Ӧ��������Ⱦ�����ȥ��