题目内容
【题目】将总物质的量为nmol的钠和铝的混合物(其中钠的物质的量分数为x)投入到一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体VL。下列关系式正确的是( )
A.x=![]()
B.0<x<0.5
C.V=33.6n(1-x)
D.11.2n<V≤22.4n
【答案】D
【解析】
将总物质的量为n mol的钠和铝混合物投入一定量的水中充分反应,钠先与水反应生成氢氧化钠与氢气,铝再与氢氧化钠反应生成偏铝酸钠与氢气。反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑;金属没有剩余,铝不与水反应,说明反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑中铝与氢氧化钠恰好完全或氢氧化钠过量,以此进行计算。
金属没有剩余,说明反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑中铝与氢氧化钠恰好完全或氢氧化钠过量,否则剩下铝不与水反应;
若恰好反应,即钠与铝按1:1混合,x=0.5,则有钠0.5nmol,铝0.5nmol,由方程式2Na+2H2O═2NaOH+H2↑可知,0.5nmol钠生成氢气0.25nmol;由方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,0.5nmol铝生成氢气0.75nmol,所以共生成氢气:0.25nmol+0.75nmol=nmol,氢气体积为22.4n L;
若Na过量,即1>x>0.5,则有钠nxmol,铝n(1x)mol,由方程式2Na+2H2O═2NaOH+H2↑可知,nxmol钠生成氢气0.5nxmol;由方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,n(1x)mol铝生成氢气1.5n(1x)mol,所以共生成氢气:0.5nxmol+1.5n(1x)mol=n(1.5x)mol,氢气体积为:22.4n(1.5x) L;
根据分析可知,Na越多气体总量越少,当即全是钠时,即x=1,生成氢气体积为11.2n L;
所以生成氢气在标况下的体积为11.2n L<VL≤22.4n L,
故答案选D。

【题目】(1)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
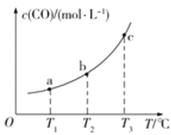
①该反应△H_____________0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_____________K2(填“>”、“<”或“=”)。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
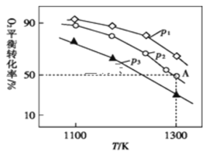
①p1、p2、p3的大小:___________。
②若初始时通入7.0molO2,p2为7.0kPa,则A点平衡常数Kp=___________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
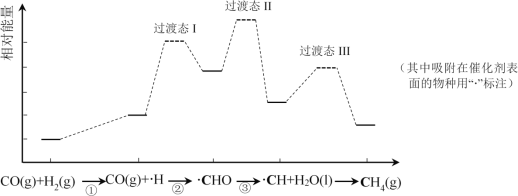
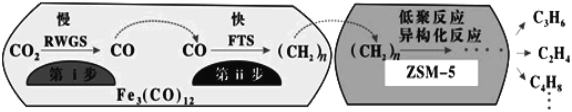
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是:___________
②下列说法正确的是______;
a.第ⅰ步的反应为:CO2+H2![]() CO+H2O
CO+H2O
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同