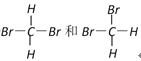题目内容
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为__________________________。(溶液混合时体积变化忽略,下同)
(3)已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(4)25℃时,amol/L氨水和0.01mol/L盐酸等体积混合充分反应后,c(NH4+)= c(Cl-)求一水合氨的电离常数K= _____________
【答案】H2A ![]() H++HA HA
H++HA HA![]() H++A2 > c(Na+)>c(A2)>c(OH)>c(HA)>c(H+) 5.4×1010
H++A2 > c(Na+)>c(A2)>c(OH)>c(HA)>c(H+) 5.4×1010 ![]()
【解析】
多元弱酸电离一步一步电离,混合溶液先找出溶质,再分析溶液酸碱性,再分析离子浓度大小关系,加离子沉淀,先将离子沉淀后求剩余的离子浓度,再通过Ksp来计算所求离子的浓度大小,混合后求平衡常数,一定找出平衡常数所涉及到的离子浓度,一定注意体积变化,浓度发生改变。
⑴根据题中信息得出酸H2A为二元弱酸,其电离方程式H2A![]() H++HA,HA
H++HA,HA![]() H++A2,
H++A2,
故答案为H2A![]() H++HA,HA
H++HA,HA![]() H++A2;
H++A2;
⑵若溶液M由10mL 2 mol·L-1NaHA溶液与10mL 2mol·L-1NaOH溶液混合得到溶质为Na2A,M要发生水解,故溶液M的pH > 7,溶液中水解离子方程式A2+H2O![]() OH + HA,HA+H2O
OH + HA,HA+H2O![]() OH+ H2A,H2O
OH+ H2A,H2O![]() H+ + OH,溶液中离子浓度由大到小顺序为c(Na+)>c(A2)>c(OH)>c(HA)>c(H+);
H+ + OH,溶液中离子浓度由大到小顺序为c(Na+)>c(A2)>c(OH)>c(HA)>c(H+);
故答案为>;c(Na+)>c(A2)>c(OH)>c(HA)>c(H+);
⑶已知Ksp(BaA)= 1.8×10-10,向⑵的混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,
A2- + Ba2+ ==BaA↓
1mol 1mol
0.02mol 0.01mol
两者反应生成沉淀,剩余n(A2) =0.01 mol,![]() ,
,
混合后溶液中的Ba2+浓度为 ,
,
故答案为5.4×1010;
⑷25℃时,a mol/L氨水和0.01mol/L盐酸等体积混合充分反应后,
c(NH4+)= c(Cl) =0.005 mol/L,c(H+) = c(OH-),则一水合氨的电离常数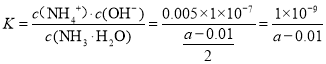
故答案为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】请综合运用所学知识,填写下列空白:
(1)①中和热测定实验中,除了烧杯、温度计、泡沫塑料、泡沫塑料板外,还需要使用的仪器有_____。
②下列关于中和热的说法正确的是______
A.用稀硫酸和Ba(OH)2溶液代替盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸溶液的温度后,用蒸馏水洗净再测NaOH溶液温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
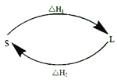
(2)①某反应历程,假设体系的始态为S,终态为L,它们之间的变化用两段弧线(可以包含任意数目的中间步骤)连接如图所示,则△H1+△H2=______。
②已知C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______。
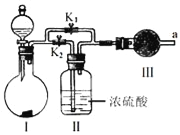
(3)①用如图所示装置,在一定条件下讨论锌与稀硫酸的反应速率时,采用一些方法测定了下列物理量,其中可以用于表示(或计算)其化学反应速率的是______
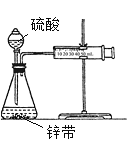
A.收集10mL H2所用的时间 B.一定时间内收集H2的体积
C.一定时间内溶液中H+的浓度变化 D.一定时间内锌粒质量的变化
E.一定时间内反应热量的变化
②为加快一定量的Zn与足量稀硫酸反应的速率,且不影响生成H2的总量,下列措施可行的是_____
A.加入少量CuSO4溶液 B.对反应液适当加热
C.将稀硫酸换成浓硫酸 D.将锌粒换成锌粉
(4)反应a M(g)+a N(g)![]() b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
b W(g)+c Z(g),在体积相同且恒定的两个容器中,按照下列方式加入原料,一段时间后达到平衡:
开始时 | 平衡时 | |||
容器1 | 2mol M | 1mol N | 总压P1 | 0.5mol W |
容器2 | 1mol M | 2mol N | 总压P2 | x mol W |
则x=____,P1_____P2(填“>”、“<”或“=”)。