题目内容
【题目】一定质量的镁、铝混合物投到2mol·L-1的盐酸中,待金属完全溶解后,再向溶液中逐滴加入2mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。
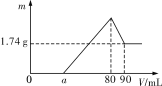
则:
(1)0~amL、a~80mL、80~90mL对应反应的离子方程式分别为:
①0~amL:___;
②amL~80mL:__、__;
③80mL~90ml:___。
(2)金属铝的质量为___。
(3)盐酸的体积是__mL。
(4)![]() =__。
=__。
(5)a=__。
【答案】OH-+H+=H2O Al3++3OH-=Al(OH)3↓ Mg2++2OH-=Mg(OH)2↓ Al(OH)3+OH-=AlO2-+2H2O 0.54g 80 1.5(或3∶2) 20(mL)
【解析】
0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁,
(1)①0~amL为氢氧化钠与氯化氢反应生成氯化钠和水;
②amL~80mL为氢氧化钠分别于氯化铝和氯化镁反应生成氢氧化铝和氢氧化镁沉淀与氯化钠;
③80mL~90ml为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(2)氢氧化钠的体积在80至90mL段内,所有的氢氧化钠用于溶解氢氧化铝,根据氢氧化钠的量确定氢氧化铝的量,根据原子守恒确定金属铝的量;
(3)加入80mL氢氧化钠溶液时,溶质为NaCl,根据质量守恒可以计算出氯化氢的物质的量,再根据V=![]() 计算出盐酸的体积;
计算出盐酸的体积;
(4)由图得到氢氧化镁的质量,根据公式计算出氢氧化镁的物质的量,根据原子守恒确定金属镁的量;
(5)根据金属镁和铝的物质的量算出氯化铝和氯化镁的物质的量,根据化学方程式算出氢氧化钠反应的物质的量,用公式算出体积,则a=80-氢氧化钠的体积,据此解答。
0~a段没有生成沉淀,说明盐酸过量,加入的氢氧化钠与氯化氢反应;a~80段开始生成沉淀,加入80mL氢氧化钠溶液后沉淀达到最大量,此时溶液中的溶质为NaCl;80~90段氢氧化铝开始溶解,溶解氢氧化铝消耗了10mLNaOH,则氢氧化铝沉淀的物质的量为:2mol/L×0.01L=0.02mol;当加入90mLNaOH溶液后氢氧化铝完全溶解,此时沉淀只有氢氧化镁;
(1)①0~amL为氢氧化钠与氯化氢反应生成氯化钠和水,离子方程式为:OH-+H+=H2O;
②amL~80mL为氢氧化钠分别于氯化铝和氯化镁反应生成氢氧化铝和氢氧化镁沉淀与氯化钠,离子方程式为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓;
③80mL~90ml为氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:OH-+H+=H2O;Al3++3OH-=Al(OH)3↓;Mg2++2OH-=Mg(OH)2↓;Al(OH)3+OH-=AlO2-+2H2O;
(2)从横坐标80mL到90mL这段可以得出:n(Al(OH)3)=n(NaOH)=0.01L×2mol/L=0.02mol,则n(Al)=n(Al(OH)3)=0.02mol,原混合物中铝的质量为:27g/mol×0.02mol=0.54g;故答案为:0.54g;
(3)加入80mL氢氧化钠溶液时,溶质为NaCl,则n(HCl)=n(NaOH)=2mol/L×0.08L=0.16mol,盐酸的体积为:![]() =0.08L=80mL;故答案为:80;
=0.08L=80mL;故答案为:80;
(4)由图可知m(Mg(OH)2)=1.74g,则n(Mg)=n(Mg(OH)2)=![]() =0.03mol,
=0.03mol,![]() =
=![]() =1.5;故答案为:1.5(或3∶2);
=1.5;故答案为:1.5(或3∶2);
(5)根据元素守恒,n(MgCl2)= n(Mg) =0.03mol,n(AlCl3)=n(Al)=0.02mol,与氢氧化钠反应生成氢氧化镁和氢氧化铝两种沉淀时消耗的n(NaOH)=2n(MgCl2)+3n(AlCl3)=![]() =0.12mol,则V(NaOH)=
=0.12mol,则V(NaOH)=![]() =0.06L=60mL,则与氯化氢反应的氢氧化钠的体积a=80mL-60mL=20mL,故答案为:20(mL)。
=0.06L=60mL,则与氯化氢反应的氢氧化钠的体积a=80mL-60mL=20mL,故答案为:20(mL)。

 阅读快车系列答案
阅读快车系列答案