题目内容
【题目】把1 mol CH4 和一定量Cl2组成的混合气体通入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:

(1)片刻后试管中的现象为:
①试管内气体的颜色变浅,②试管壁上出现_________________________、③试管内__________________、____________________。
(2)在反应结束后,试管内的产物最多的是___________,空间构型呈正四面体的产物为___________。
(3)若(2)中生成的四种有机产物的物质的量相同,则反应消耗的Cl2的物质的量为________mol。
(4)与CH4相邻同系物的结构简式为_______________该同系物与Cl2发生一氯取代反应的化学方程式为__________________________。
【答案】油状液滴 出现白雾 液面上升 HCl CCl4 2.5 CH3CH3 或CH3-CH3 ![]()
【解析】
对甲烷与氯气反应实验现象的理解,取代反应实质是一个原子(或原子团)代替另外一个原子(或原子团)。
把1 mol CH4 和一定量Cl2组成的混合气体通入大试管中,将此试管倒立在盛有饱和食盐水的水槽中,放在光亮处,
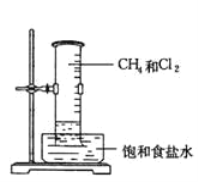
⑴片刻后试管中的现象为:氯气和甲烷在光照条件下发生反应,颜色逐渐变浅,试管内出现白雾,试管壁上出现油状液体,试管内液面上升,
故答案为油状液滴;出现白雾;液面上升;
⑵甲烷和氯气是一系列的反应,每一步反应都生成HCl,因此试管内的产物最多的是HCl,空间构型呈四面体有一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳,但呈正四面体的产物为四氯化碳,
故答案为HCl;CCl4;
⑶若⑵中生成的四种有机产物的物质的量相同即一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳各0.25 mol,根据反应方程式分析每取代一个氢原子消耗一个氯气,取代1 mol氢原子,消耗1 mol氯气,因此0.25mol×(1 + 2 + 3 + 4)=2.5 mol,则反应消耗的Cl2的物质的量为2.5mol,
故答案为2.5;
⑷与CH4相邻同系物为乙烷,其结构简式为CH3CH3或CH3—CH3,该同系物与Cl2发生一氯取代反应的化学方程式为CH3CH3 + Cl2 ![]() CH3CH2Cl + HCl。
CH3CH2Cl + HCl。
故答案为CH3CH3或CH3—CH3;CH3CH3 + Cl2 ![]() CH3CH2Cl + HCl。
CH3CH2Cl + HCl。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a_____0;ΔS______0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g)![]() 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______。
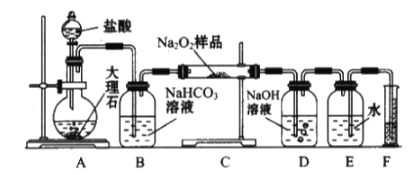
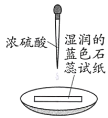
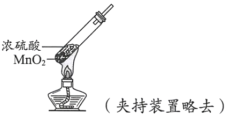
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性