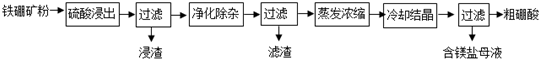
题目内容
4.高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O,下列说法正确的是( )| A. | ClO-做还原剂 | |
| B. | 制备1molK2FeO4时转移3mol 电子 | |
| C. | 高铁酸钾中铁的化合价为+7 | |
| D. | Fe(OH)3在反应中被还原,发生还原反应 |
分析 2Fe(OH)3+3KClO+4KOH═2K2FeO4+3KCl+5H2O中,Fe元素的化合价由+3价升高为+6价,Cl元素的化合价+1价降低为-1价,以此来解答.
解答 解:A.Cl元素的化合价降低,则制备高铁酸钾用ClO-做氧化剂,故A错误;
B.制备高铁酸钾时1 mol Fe(OH)3失去3 mol 电子,故B正确;
C.K为+1价,O为-2价,由化合物中正负化合价的倒数和为0可知,高铁酸钾中铁的化合价为+6,故C错误;
D.Fe元素的化合价由+3价升高为+6价,所以Fe(OH)3在反应中被氧化,发生氧化反应,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注重化学与生活的联系,考查点较多,题目难度不大.

练习册系列答案
相关题目
16.已知PbO2受热分解为Pb的+4和+2价的混合氧化物,其中PbO2能氧化浓盐酸生成Cl2.现加热分解1moI PbO2得到O2和剩余固体,再向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为1:2,则加热分解后剩余固体的组成及物质的量之比是( )
| 选项 | 剩余固体 | 剩余固体的物质的量之比 |
| A | Pb3O4,PbO | 1:1 |
| B | PbO2,Pb3O4 | 1:1 |
| C | PbO2,Pb3O4,PbO | 1:2:1 |
| D | PbO2,Pb3O4,PbO | 1:1:2 |
| A. | A | B. | B | C. | C | D. | D |
19.水溶液中能大量共存的一组离子是( )
| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO42-、MnO4- | ||
| C. | Na+、H+、NO3-、HCO3- | D. | Cl-、NO3-、Fe2+、H+ |
10.在一瓶某物质的饱和溶液中,在温度不变时,加人少量该溶质固体,则( )
| A. | 溶液的质量增大 | B. | 溶质的溶解度增大 | ||
| C. | 溶液的浓度不变 | D. | 固体的质量一定不变 |
 化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.
化学科学的重要责任在于认识自然界里存在的各种各样的、奇妙的化学反应,探索纷繁的化学反应的本质和规律.通过化学反应原理模块的学习,我们可以比较深刻地理解化学科学的精髓,提高化学学科素养.请根据所学化学反应原理,解决以下问题.