题目内容
9.硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5•H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示: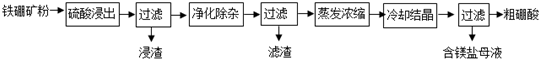
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.9、9.7和12.4.
回答下列问题:
(1)为提高“浸出”速率,除适当增加硫酸浓度外,还可采取的措施有提高反应温度或减小铁硼矿粉粒径;
(2)实验室中过滤操作所需要的玻璃仪器有:玻璃棒、烧杯和漏斗;
(3)“浸渣”中的物质是SiO2、CaSO4(化学式);
(4)“净化除杂”需先加H2O2溶液,作用是将亚铁离子氧化为铁离子,然后再调节溶液的pH约为5,目的是使铁离子、铝离子形成氢氧化物沉淀而除去;
(5)“粗硼酸”中的主要杂质是七水硫酸镁(填名称);
(6)单质硼可用于生产具有优良抗冲击性能的硼钢.以硼酸和金属镁为原料在加热条件下可制备单质硼,
用化学方程式表示制备过程2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O、B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO.
分析 以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3),由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,“净化除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,调节溶液的pH约为5,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3,以此来解答.
解答 解:以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3),由流程可知,加硫酸溶解只有SiO2不溶,CaO转化为微溶于水的CaSO4,“净化除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,调节溶液的pH约为5,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3,
(1)为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有提高反应温度或减小铁硼矿粉粒径等,
故答案为:提高反应温度或减小铁硼矿粉粒径;
(2)实验室中过滤操作所需要的玻璃仪器有:玻璃棒、烧杯和漏斗,
故答案为:烧杯和漏斗;
(3)铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)中SiO2不溶于硫酸,另外溶解过程中产生硫酸钙微溶,所以“浸渣”中还剩余的物质是SiO2、CaSO4,
故答案为:SiO2、CaSO4;
(4)“净化除杂”需先加H2O2溶液,作用是将亚铁离子氧化为铁离子.然后在调节溶液的pH约为5,目的是使铁离子、铝离子形成氢氧化物沉淀而除去,
故答案为:将亚铁离子氧化为铁离子;使铁离子、铝离子形成氢氧化物沉淀而除去;
(5)最后浓缩结晶时硫酸镁易结合水以晶体析出,则“粗硼酸”中的主要杂质是七水硫酸镁,
故答案为:七水硫酸镁;
(6)以硼酸和金属镁为原料可制备单质硼的化学方程式为2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O、B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO,
故答案为:2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O、B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握实验流程及发生的反应、混合物分离提纯方法为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

| A. | 提倡使用太阳能、风能、天然气、地热能等新能源,以保护环境 | |
| B. | “玉兔号”的太阳能电池板主要由二氧化硅制成 | |
| C. | 为除去锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加盐酸溶解 | |
| D. | 碱性洗涤剂的去污能力比中性洗涤剂弱,是由于油脂在中性溶液中更易水解 |
| A. | ClO-做还原剂 | |
| B. | 制备1molK2FeO4时转移3mol 电子 | |
| C. | 高铁酸钾中铁的化合价为+7 | |
| D. | Fe(OH)3在反应中被还原,发生还原反应 |
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═AlO2-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na:2 Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ |
 一块表面被氧化的铝分成两等分,若向其中一份中滴加1mol•L-1的NaOH溶液,向另一份中滴加x mol•L-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )
一块表面被氧化的铝分成两等分,若向其中一份中滴加1mol•L-1的NaOH溶液,向另一份中滴加x mol•L-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )| A. | 该铝块的总质量为8.46g | |
| B. | a=260 | |
| C. | b=780 | |
| D. | 该铝块中氧化铝与铝单质的物质的量之比为3:20 |
(1)若某药品质量约为32.0g, 托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下.
50g | 20g | 20g | 10g | 5g |
(2)配制500mL 0.1mol.L-1 Na2CO3溶液,图中操作②中应该填写的数据为__________,实验操作的先后顺序为________________ (填编号)。
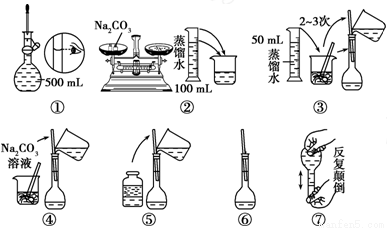
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响。
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度___________
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度___________
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度___________
 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题: 据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.
据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.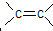 空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.
空间结构,且是不能旋转不然,双键就会被破坏,而单键是可以旋转的,则肯定共线的原子最多有12个.