题目内容
15.已知 A、B、C、D、E、F 五种短周期元素,A的最外层电子数是其电子层数的3倍,A、B同主族,A、F同周期,F是形成化合物种类最多的元素,C在短周期主 族元素中原子半径最大,E2是黄绿色气体,D为金属元素,其单质可以用于冶炼Fe.(1)D在周期表中的位置是第三周期ⅢA 族; A、B、C离子半径由大到小的顺序为S2->O2->Na+.(用离子符号表示)
(2)工业上用E的单质制备漂白粉的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;将少量C2A2加 入水中可观察到的实验现象是浅黄色固体溶解,有无色无味气体放出;向所得溶液中加入酚酞可观察到溶液先变红后褪色,由此说明溶液中有NaOH、H2O2(填化学式)两种物质生成.
(3)D与Fe2O3的反应还可以用于定向爆破,其化学反应方程式为2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(4)D单质与C的高价物化物的水化物反应放气体,其反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
分析 A、B、C、D、E、F 五种短周期元素,A的最外层电子数是其电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;A、B同主族则B为S元素;A、F同周期,F是形成化合物种类最多的元素,则F为碳元素;C在短周期主族元素中原子半径最大,则C为Na;E2是黄绿色气体,则E为Cl;D为金属元素,其单质可以用于冶炼Fe,则D为Al,据此解答.
解答 解:A、B、C、D、E、F 五种短周期元素,A的最外层电子数是其电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;A、B同主族则B为S元素;A、F同周期,F是形成化合物种类最多的元素,则F为碳元素;C在短周期主族元素中原子半径最大,则C为Na;E2是黄绿色气体,则E为Cl;D为金属元素,其单质可以用于冶炼Fe,则D为Al.
(1)D为Al元素,在周期表中的位置是:第三周期ⅢA 族; A、B、C离子分别为O2-、S2-、Na+,电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径由大到小的顺序为S2->O2->Na+,
故答案为:第三周期ⅢA 族;S2->O2->Na+;
(2)工业上用氯气制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;将少量Na2O2加 入水中可观察到的实验现象是:浅黄色固体溶解,有无色无味气体放出,向所得溶液中加入酚酞可观察到溶液先变红后褪色,由此说明溶液中有NaOH、H2O2两种物质生成,
故答案为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;浅黄色固体溶解,有无色无味气体放出;NaOH、H2O2;
(3)Al与Fe2O3的反应还可以用于定向爆破,其化学反应方程式为:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(4)C的高价物化物的水化物为NaOH,Al与氢氧化钠反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,难度中等.

| A. | NH4+ | B. | NH2- | C. | NH3 | D. | Na+ |
| A. | C60、D2O、SiO2都属于化合物 | |
| B. | 漂白粉、石英、Fe(OH)3胶体都属于纯净物 | |
| C. | BaSO4、NH4Cl、NaOH都属于强电解质 | |
| D. | CO2、SO3、NO 都属于酸性氧化物 |
| A. | 容器中混合气体的平均相对分子质量增大 | |
| B. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 正反应速率和逆反应速率都变小,C的百分含量增加 | |
| D. | 混合气体密度的变化情况不可以作为判断反应是否再次达平衡的依据 |
| A. | 工业上制取Y的单质常用还原剂还原Y的氧化物 | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | 室温下,X的最高价氧化物的水溶液的pH>7 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
| A. | ClO-做还原剂 | |
| B. | 制备1molK2FeO4时转移3mol 电子 | |
| C. | 高铁酸钾中铁的化合价为+7 | |
| D. | Fe(OH)3在反应中被还原,发生还原反应 |
| A. | 若该反应在较低温度下能自发进行,则△H<0 | |
| B. | 在该温度下上述反应的平衡常数K=4 | |
| C. | 达到平衡时生成了0.125amol CaS | |
| D. | 向上述体系中加入石灰石,能提高CO的转化率 |
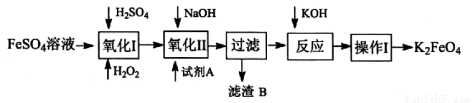
 Fe(OH)3(胶体)+ KOH + 。
Fe(OH)3(胶体)+ KOH + 。
 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等.回答下列问题: